
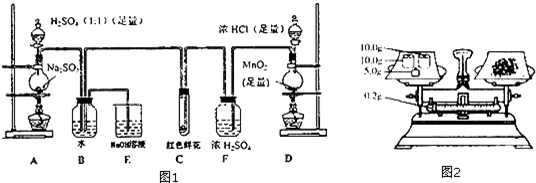
分析 A装置产生二氧化硫,D装置产生氯气在F装置中干燥,C装置检验干燥氯气的漂白性,氯气和二氧化硫在B装置中反应,E装置吸收尾气,防止污染空气.
(1)根据装置图填写仪器名称;
(2)应先准备氯气,保证二氧化硫被完全氧化;
(3)A为实验室制备二氧化硫的发生装置,D为实验室制备氯气的发生装置,氯气具有氧化性,二氧化硫具有还原性,在B中发生氧化还原反应生成盐酸和硫酸;
(4)红色鲜花中含水,水和氯气反应生成盐酸和次氯酸,次氯酸具有漂白作用;氯气和二氧化硫有毒,E中NaOH溶液吸收尾气防止污染;
(5)根据图示读取样品质量,根据硫元素守恒计算,Na2SO3~SO2~BaSO4;按题给装置和操作进行实验,二氧化硫与氯气不一定能充分接触,使得二氧化硫有可能没有完全被氧化而被氢氧化钠吸收,导致硫酸钡质量减少,据此分析.
解答 解:(1)装置中所用玻璃仪器为:圆底烧瓶、分液漏斗和酒精灯,
故答案为:圆底烧瓶、分液漏斗;
(2)应先准备氯气,保证二氧化硫被完全氧化,故先加热D处酒精灯,
故答案为:D;
(3)D为实验室制备氯气的发生装置,反应为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑2H2O,A中是实验室制备二氧化硫的装置,反应的化学方程式为:H2SO4+Na2SO3═Na2SO4+H2O+SO2↑,氯气具有氧化性,二氧化硫具有还原性,在B中发生氧化还原反应生成盐酸和硫酸,反应为:Cl2+SO2+2H2O═4H++2Cl-+SO42-;
故答案为:Cl2+SO2+2H2O═4H++2Cl-+SO42-;
(4))红色鲜花中含水,水和氯气反应生成盐酸和次氯酸,次氯酸具有漂白作用,故红色鲜花褪色;氯气和二氧化硫有毒,二氧化硫在溶液中反应生成亚硫酸钠和水,反应的离子方程式为:SO2+2OH-═SO32-+H2O;氯气在其溶液中反应生成NaCl和NaClO,反应为:Cl2+2OH-═Cl-+ClO-+2H2O,故E中NaOH溶液吸收尾气防止污染;
故答案为:红色鲜花褪色;吸收未反应的二氧化硫和氯气;
(5)根据硫元素守恒计算,
Na2SO3~SO2~BaSO4
126g 233g
m 23.3g
m=$\frac{126g×23.3g}{233g}$=12.6g,
样品质量为:10.0g+10.0g+5.0g-0.2g=24.8g,
所以Na2SO3的质量分数为 $\frac{12.6g}{24.8g}$×100%=50.8%,
按题给装置和操作进行实验,二氧化硫与氯气不一定能充分接触,使得二氧化硫有可能没有完全被氧化而被氢氧化钠吸收,导致硫酸钡质量减少,则由此计算的亚硫酸钠的质量减少,质量分数偏低,
故答案为:50.8%;偏低.
点评 本题考查实验基本操作、二氧化硫和氯气的性质,较基础,注意从实验目的考虑加热的先后顺序,抓住原子守恒进行计算,难度中等.


科目:高中化学 来源: 题型:解答题
 2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.
2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
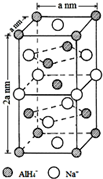 氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示. .
. .
.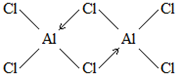 (标明配位键).
(标明配位键).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 主要仪器 | 试剂 |
| A | 配制480mL 2mol/L的NaOH溶液 | 胶头滴管、烧杯、玻璃棒、托盘天平、480mL容量瓶 | NaOH固体、蒸馏水 |
| B | 分离I2和CCl4的混合物 | 分液漏斗、烧杯 | 乙醇 |
| C | 鉴别Na2CO3和NaHCO3溶液 | 试管、胶头滴管 | 澄清石灰水 |
| D | 鉴别葡萄糖和蔗糖 | 试管、烧杯、酒精灯 | 葡萄糖溶液、蔗糖溶液、银氨溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
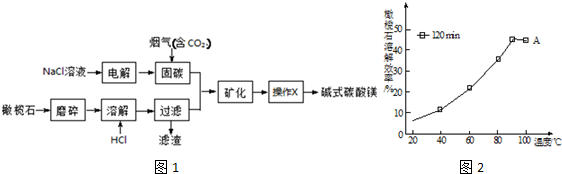
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
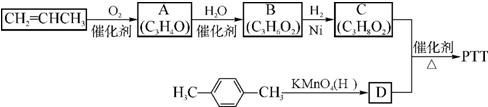
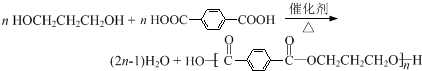 ,反应类型为缩聚反应.
,反应类型为缩聚反应. (须注明反应条件).
(须注明反应条件).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
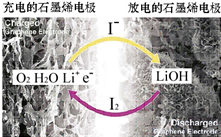 科学家开发出一种新型锂-氧电池,其能量密度极高,效率达到90%以上,电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:O2+4LiI+2H2O$?_{充电}^{放电}$2I2+4LiOH对于该电池的下列说法不正确的是( )
科学家开发出一种新型锂-氧电池,其能量密度极高,效率达到90%以上,电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:O2+4LiI+2H2O$?_{充电}^{放电}$2I2+4LiOH对于该电池的下列说法不正确的是( )| A. | 充电时阴极反应为LiOH+e-═Li+OH | |
| B. | 充电时Li+从阳极区移向阴极区 | |
| C. | 放电时正极反应为O2+2H2O+4Li++4e-═4LiOH | |
| D. | 放电时负极上I- 被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠(s) | B. | 醋酸钠(s) | C. | 亚硫酸钠(aq) | D. | 硝酸钾(aq) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com