
把7.4g Na2CO3·10H2O和NaHCO3组成的混合物溶于水,配成100 mL溶液,其中c(Na+)=0.6 mol·L-1。若把等质量的混合物加热到恒重时,残留物的质量是
A.3.18 g B.2.21 g C.5.28 g D.4.22 g
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源:2016届山东省高三上学期第一次诊断测试化学试卷(解析版) 题型:选择题
下列实验操作中,装置选择不合理的是
A | B | C | D |
|
|
|
洗气瓶 |
快速制备少量NH3 | H2的尾气处理 | 测量NO的体积 | 除去乙烯中的SO2 |
查看答案和解析>>
科目:高中化学 来源:2016届山东省邹城市高三上学期10月月考化学试卷(解析版) 题型:填空题
某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子中的一种或几种.当向该溶液中加入一定物质的量的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如图所示.

(1)原溶液中一定含有____________,一定不含有____________;
(2)cd段发生的离子反应为___ _________;
(3)原溶液中物质的量浓度最大的阳离子与原溶液中的阴离子的物质的量之比为__________________.
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高一上学期第一次月考化学试卷(解析版) 题型:填空题
(12分)化学试剂应根据其性质和形态进行有效妥善保存:固体试剂应保存在 ,液体试剂保存在 ,见光易分解的试剂(如:浓HNO3、AgNO3等)应用 色试剂瓶保存。氢氟酸(HF)因和玻璃中的SiO2强烈反应而腐蚀玻璃,应用 存放;金属钠、钾应保存在 中;少量白磷应该保存在 中。
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期期中测试化学试卷(解析版) 题型:填空题
(12 分)现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。

已知①BrO3-+6I一+6H+=3I2+Br-+3H2O;
②2BrO3- +I2 = 2IO3- + Br2;
请回答下列问题:
(1)由反应②有同学由此得出氧化性:I2>Br2的结论,你认为是否正确 (填是或否),并说明理由 。
(2)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为 ,还原产物是 。
(3)b→c过程中只有一种元素的化合价发生变化,写出该过程的离子反应方程式 。
(4)含6 mol KI的硫酸溶液所能消耗n(KBrO3)的最大值为 mol。
(5)n(KBrO3)=4时,对应含碘物质的化学式为 。
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省绥化市高三上学期期中测试化学试卷(解析版) 题型:填空题
(9分)由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去):

(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通入CO2,无明显变化,说明样品中不含有的物质是(填写化学式)___________。
(2)Z为一种或两种气体
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应Ⅰ中能同时生成两种气体的化学方程式是_________。
②若Z为两种气体的混合物,试剂a为适量水,则Z中两种气体的化学式是_____________。
(3)向Y中通入过量氯气,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)_____________。
(4)取Y中的溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成.当消耗2 mol I- 时,共转移3 mol电子,该反应的离子方程式是_______________。
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省绥化市高三上学期期中测试化学试卷(解析版) 题型:选择题
下列离子方程式与所述事实相符且正确的是
A.向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应:4Fe2++2Br-+3Cl2=== 4Fe3++6Cl-+Br2
B.磁性氧化铁溶于氢碘酸:Fe3O4+8H+=== 2Fe3++Fe2++4H2O
C.放置在空气中的淀粉碘化钾溶液一段时间后溶液呈蓝色:4H++4I-+O2===2I2+2H2O
D.向硝酸铵溶液中滴加NaOH溶液:NH4++OH-=== NH3↑+ H2O
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期10月阶段测化学试卷(解析版) 题型:选择题
下列说法正确的是
A.将25 g CuSO4·5H2O溶于100 mL蒸馏水中,可以配成100 mL 1.0 mol/L CuSO4溶液
B.可以用重结晶法除去KNO3固体中混杂的NaCl,这是因为NaCl在水中的溶解度很大
C.利用实验器材(规格和数量不限):烧杯、玻璃棒、胶头滴管、分液漏斗,能完成用溴水和CCl4除去NaBr溶液中的少量NaI的实验
D.用润湿的pH试纸测稀酸溶液的pH,测定值偏小
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省泰州市姜堰区高二上学期期中选修化学试卷(解析版) 题型:填空题
用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A:4HCl(g)+O2(g)  2Cl2(g)+2H2O(g)。
2Cl2(g)+2H2O(g)。
(1)研究表明反应A通过如下图所示的催化剂循环实现。
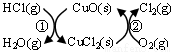
反应①为:2HCl(g)+CuO(s) H2O(g)+CuCl2(g) ΔH1
H2O(g)+CuCl2(g) ΔH1
反应②生成1 mol Cl2(g)的反应热为ΔH2,则A反应的反应热表示为 。(用ΔH1和ΔH2表示)。
(2)反应A中,4mol HCl被氧化,放出115.6kJ的热量,且部分化学键断裂示意图如下:
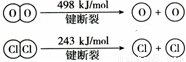
①H2O的电子式是 ,反应A的热化学方程式是 。
②断开1 mol H—O键与断开 1 mol H—Cl 键所需能量相差约为 kJ,H2O中H—O 键比HCl中H—Cl键 (填“强”或“弱”)。
(3)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性。

实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的ɑHCl—T曲线如上图所示,若压缩体积使压强增大,画出相应ɑHCl—T曲线的示意图,并简要说明理由 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com