
【题目】一定条件下,在恒容密闭容器中,能表示反应X(g)+2Y(g)![]() 2Z(g)一定达到化学平衡状态的是
2Z(g)一定达到化学平衡状态的是
A.容器中的压强不再发生变化
B.X、Y、Z的物质的量之比为1:2:2
C.X、Y、Z的速率之比1:2:2
D.单位时间内生成n mol Z,同时消耗n mol Y
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】Cu(OH)2在水溶液中存在着如下沉淀溶解平衡:Cu(OH)2(s) Cu2+(aq)+2OH-(aq),在常温下Ksp=2×10-20。在常温下如果要生成Cu(OH)2沉淀,需要向0.02mol/L的CuSO4溶液中加入碱来调整溶液的pH,应使溶液的pH大于( )
A.3B.4C.5D.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的资源化利用能有效减少CO2排放,充分利用碳资源。
(3)CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH =41.2 kJ·mol1
CO(g)+H2O(g) ΔH =41.2 kJ·mol1
反应Ⅱ:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol1
CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol1
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:CH3OCH3的选择性=![]() ×100%
×100%
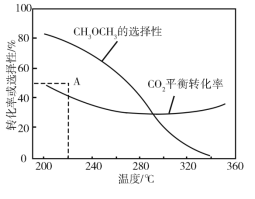
①温度高于300 ℃,CO2平衡转化率随温度升高而上升的原因是________。
②220 ℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关能量的叙述不正确的是
A.H2(g)的燃烧热是H=-285.8kJ/mol,则反应2H2O(g)=2H2(g)+O2(g)的反应热H=+571.6kJ/mol
B.化学键的断裂和形成是物质在化学变化中能量变化的主要原因
C.活化能的大小对化学反应前后的能量变化不产生影响
D.化学反应过程中同时存在物质变化和能量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放出25.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol·L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至终点,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶中加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。试回答下列问题:
(1)滴定终点时的现象为:______________________________________;
(2)滴定时边滴边摇动锥形瓶,眼睛应观察_________________________;
(3)该小组在步骤①中的错误是________________,由此造成的测定结果 ______(填“偏高”或“偏低”或“无影响”);
(4)步骤②缺少的操作是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铵(NH4ClO4)为白色晶体,是强氧化剂,常用作火箭发射的推进剂。已知:①NH4ClO4在400℃时开始分解,产物为N2、Cl2、O2、H2O;②Mg3N2易水解。请用下图所示装置设计实验证明分解产物中含有Cl2、H2O以及装置A中生成了Mg3N2(装置不重复使用)。
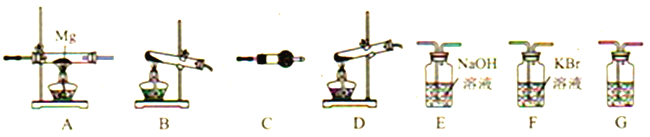
(1)写出高氯酸铵分解的化学方程式__________。
(2)高氯酸铵分解选择的装置是__________(填字母)。
(3)按气流从左到右,装置的连接顺序是:分解装置→_____→_____→_____→_____→_____。______________
(4)C中所放的试剂是__________,G的作用是__________ 。
(5)能证明有Cl2产生的现象是__________。
(6)要证明装置A中生成了Mg3N2需要进行的实验操作以及对应的实验现象是__________。
(7)某实验宣存放的高氯酸铵样品中含有少量杂质,已知可用蒸馏法测定NH4ClO4的含量,其测定流程如下(杂质不参加反应),则样品中NH4ClO4的含量(w)为__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物分子式为 C4H8,据此推侧其结构和性质不可能的是
A. 它与乙烯可能是同系物
B. 一氯代物只有一种
C. 分子结构中甲基的数目可能是 0、1、2
D. 等质量CH4和C4H8分别在氧气中完全燃烧,CH4的耗氧量小于C4H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为几种晶体或晶胞的示意图:


请回答下列问题:
(1)上述晶体中,粒子之间以共价键结合形成的晶体是____。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为:___。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能___(填“大于”或“小于”)MgO晶体,原因是____。
(4)每个Cu晶胞中实际占有___个Cu原子,CaCl2晶体中Ca2+的配位数为__。
(5)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入0.3molA、0.1molC和一定量B三种气体。一定条件下发生反应,各物质浓度随时间变化如图甲所示[t0~t1阶段c(B)未画出]。图乙为t2时刻后改变条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种条件并且所用条件均不相同。已知t3~t4阶段为使用催化剂。下列说法正确的是( )

A. 若t1等于15s,生成物C在t0~t1时间段的平均反应速率为0.004mol/(Ls)
B. t4~t5阶段改变的条件为降低反应温度
C. B的起始的物质的量为0.02mol
D. t5~t6阶段可能是增大压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com