
| A. | Na+ H+ NO3- Fe2+ | B. | Ca2+ H+ ClO- NO3- | ||
| C. | K+ H+ Cl- SO42- | D. | Fe3+ Cl- H+ CO32- |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 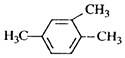 1,3,4-三甲苯 1,3,4-三甲苯 | B. | CH3CH(Cl)CH3 2-氯丙烷 | ||
| C. | 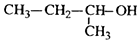 2-甲基-1-丙醇 2-甲基-1-丙醇 | D. | 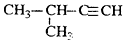 2-甲基-3-丁炔 2-甲基-3-丁炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
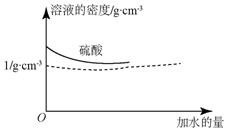 已知硫酸的密度与所加水量的关系如图所示,
已知硫酸的密度与所加水量的关系如图所示,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③④ | C. | ② | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
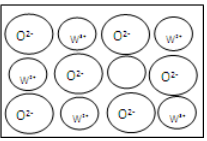 X、Y、Z、W四种元素原子序数依次增大且均小于36.Z基态原子最外层电子数是其内层电子总数的3倍,Y基态原子是同周期元素中未成对电子数最多的原子,X分别与Y、Z元素组合均可形成10电子微粒,W基态原子有10个价电子. 回答下列问题(以下问题均以推知元素符号作答):
X、Y、Z、W四种元素原子序数依次增大且均小于36.Z基态原子最外层电子数是其内层电子总数的3倍,Y基态原子是同周期元素中未成对电子数最多的原子,X分别与Y、Z元素组合均可形成10电子微粒,W基态原子有10个价电子. 回答下列问题(以下问题均以推知元素符号作答):查看答案和解析>>
科目:高中化学 来源: 题型:推断题
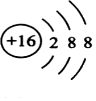 .
.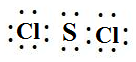 ,该反应的化学方程式为3SCl2+4H2O=2S+H2SO4+6HCl.
,该反应的化学方程式为3SCl2+4H2O=2S+H2SO4+6HCl.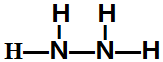 .常温下,液体乙与气体丙反应生成两种无污染的物质,若共生成1mol产物时放热QKJ,该反应的热化学方程式为2N2H4(l)+2NO2(g)=3 N2(g)+4H2O(l)△H=-7QkJ/mol.
.常温下,液体乙与气体丙反应生成两种无污染的物质,若共生成1mol产物时放热QKJ,该反应的热化学方程式为2N2H4(l)+2NO2(g)=3 N2(g)+4H2O(l)△H=-7QkJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
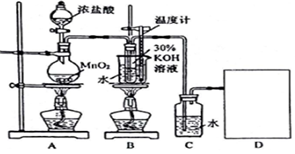
| 实验 编号 | 试剂及其用量 | |||
| 0.2mol•L-1kJ/mL | KClO3(s)/g | 6.0mol•L-1H2SO4/mL | H2O/mL | |
| 1 | 1.0 | 0.1 | 0 | a |
| 2 | 1.0 | 0.1 | 3.0 | b |
| 3 | 1.0 | 0.1 | 6.0 | c |
| 4 | 1.0 | 0.1 | 9.0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
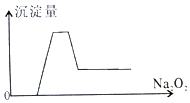 有一透明溶液,取出少量滴入BaCl2溶液,有白色沉淀生成;另取一定体积的该溶液加入过量Na2O2,有无色有刺激性味气体产生,同时有白色沉淀生成,其沉淀量(纵坐标)与加入Na2O2的量(横坐标)的关系如图所示,根据以上判断在该溶液中一定存在的离子是( )
有一透明溶液,取出少量滴入BaCl2溶液,有白色沉淀生成;另取一定体积的该溶液加入过量Na2O2,有无色有刺激性味气体产生,同时有白色沉淀生成,其沉淀量(纵坐标)与加入Na2O2的量(横坐标)的关系如图所示,根据以上判断在该溶液中一定存在的离子是( )| A. | ①②③④⑦ | B. | ①③④⑦ | C. | ①②③⑤⑦ | D. | ①③④⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com