
【题目】下列有关NH中的N—H配位键说法正确的是( )
A. N—H配位键不是化学键
B. N—H配位键属于共价键
C. N—H配位键跟其他三个N—H键之间的键长不同
D. N—H配位键的化学性质与其他N—H键不同
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有机物A常用于食品行业。已知4.5 g A在足量O2中充分燃烧,混合气体依次通过足量的浓硫酸和碱石灰,分别增重2.7 g和6.6 g,经检验剩余气体为O2。
(1)A分子的质谱图如下图所示,从图中可知其相对分子质量为___,则A的分子式是____。

(2)A能与NaHCO3溶液发生反应,A一定含有的官能团名称是________。
(3) A分子的核磁共振氢谱有4个峰,峰面积之比是1:1:1:3,则A的结构简式是______。
(4)0.05 mol A与足量Na反应,在标准状况下产生H2的体积是________L。
(5)A在一定条件下可聚合得到一种聚酯,用于制造手术缝合线,其反应的化学方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500![]() 有
有![]() 和
和![]() 的混合溶液分成5等份,取一份加入含
的混合溶液分成5等份,取一份加入含![]()
![]() 硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含
硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含![]()
![]() 硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国女药学家屠呦呦因四十多年前发现了青蒿素,有效降低疟疾患者的死亡率,从而获得2015年诺贝尔生理学或医学奖.青蒿素的分子结构如图所示,下列有关青蒿素的有关说法正确的是( )
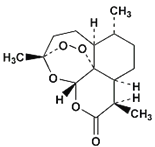
A.分子中所有碳原子可能处于同一平面上
B.分子中含氧官能团只有酯基
C.青蒿素的化学式是C15H22O5
D.青蒿素属于烃类有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小分子抗癌药物的分子结构如图所示,下列说法正确的是

A. 1mol该有机物最多可以和5mol NaOH反应
B. 该有机物容易发生加成、取代、中和、消去等反应
C. 该有机物遇FeCl3溶液不变色,但可使酸性KMnO4溶液褪色
D. 1mol该有机物与浓溴水反应,最多消耗3mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、P、Cl、Fe等元素及其化合物有重要的应用,回答下列问题:
(1)C原子的价电子轨道表达式为__________________ 。
(2)CC14分子的空间构型是______________,其中心原子采取______________杂化,与CC14互为等电子体的一种离子是__________________ (填写离子符号)。
(3)PC13属于________________分子(填“极性”或“非极性”)。
(4)FeO、NiO的晶体结构均与NaCl晶体结构相同,其中Fe2+与Ni2+的离子半径分别为 7.8×l0-2nm、6.9×l0-2nm,则熔点 FeO_________NiO (填 “>”、“ <”或“=”),原因是___________________。
(5)已知FeCl3的沸点:319℃,熔点:306℃,则FeCl3的晶体类型为______________。
(6)已知Fe单质有如图所示的两种常见堆积方式:

其中属于体心立方密堆积的是___________(填“a”或“b”);若单质Fe按a方式紧密堆积,原子半径为rpm,NA表示阿伏加德罗常数的值,则单质Fe的密度为________g·cm-3 (列出算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置进行相应的实验(部分夹持装置略去),不能达到实验目的的是
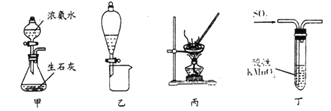
A. 利用图甲装置可快速制取少量氨气
B. 利用图乙装置分离水和溴的苯溶液
C. 利用图丙装置蒸发KCl溶液得晶体
D. 图丁装置中溶液颜色变浅,说明SO2具有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原-氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下Al2O3(s)+AlCl3(g)+3C(s) =3AlCl (g)+3CO(g) △H = a kJ·mol-1
3AlCl(g)=2Al(l)+ AlCl3 (g) △H = b kJ·mol-1
①反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=________kJ·mol-1(用含a、b的代数式表示)。
②Al4C3也是该反应过程中的一种中间产物。Al4C3 与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为_______________。
③甲烷和水反应可以制水煤气(混合气体),在恒温、固定体积为V升的密闭容器中的反应微观示意图如下所示,根据微观示意图得出的结论中,正确的是_____________。
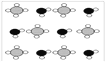
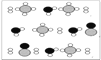
一定条件下经过t分钟达到化学平衡
a. 该反应方程式为:CH4+H2O = CO+3H2
b. 该反应平衡前后压强比为3:4
c. 该反应体系中含氢元素的化合物有3种
d. 该反应中甲烷的平衡转化率为50%
④水煤气中的H2可用于生产NH3,在进入合成塔前常用[Cu(NH3)2]Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:
[Cu(NH3)2]Ac(aq) + CO(g) + NH3(g)![]() [Cu(NH3)3]Ac·CO(aq) △H<0
[Cu(NH3)3]Ac·CO(aq) △H<0
[Cu(NH3)2]Ac溶液吸收CO的适宜生产条件应是____________________。该条件下用气体表示的平衡常数表达式为:K=______________
(2)镁铝合金(Mg17Al12 )是一种潜在的贮氢材料,一般在氩气环境中将一定化学计量比的Mg、Al 单质在一定温度下熔炼获得。该合金在一定条件下可完全吸氢得到的混合物Y(含MgH2 和Al),Y在一定条件下可释放出氢气。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是_________________。
②写出镁铝合金(Mg17Al12 ) 在一定条件下完全吸氢的化学方程式 _________________。
③在6. 0 mol·L-1 HCl 溶液中,混合物Y 能完全释放出H2。1 mol Mg17 Al12 完全吸氢后得到的混合物Y 与上述盐酸完全反应,释放出H2 的物质的量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成药物X、Y 和高聚物Z,可以用烃A为主要原料,采用以下路线。
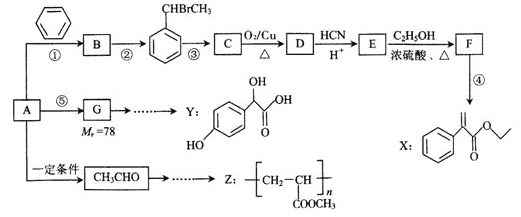
已知I.反应①、反应②的原子利用率均为100%。
II.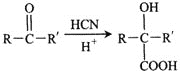 (R或R′可以是烃基或H原子)
(R或R′可以是烃基或H原子)
请回答下列问题:
(1)A的结构简式为________________。
(2)Z中的官能团名称为_____________________,反应③的条件为_________________。
(3) 关于药物Y(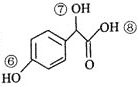 )的说法正确的是_____________________。
)的说法正确的是_____________________。
A.1mol 药物Y与足量的钠反应可以生成33.6L氢气
B.药物Y 的分子式为C8H8O4,能使酸性高锰酸钾溶液褪色
C.药物Y 中⑥、⑦、⑧三处-OH 的活泼性中强到弱的顺序是⑧>⑥>⑦
D.1mol药物Y与H2、浓溴水中的Br2反应,最多消耗分别为4mol和2mol
(4)写出反应E→F 的化学方程式________________。F→X的化学方程式_________________。
(5)写出符合下列条件的E的一种同分异构体的结构简式_________________________。
①FeCl3溶液可以发生显色反应,且是苯的二元取代物;
②能发生银镜反应和水解反应;
③核磁共振氢谱有6个峰。
(6)参考上述流程以CH3CHO和CH3OH为起始原料,其它无机试剂任选设计合成Z 的线路。__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com