
25℃和1.01×105Pa时,反应2N2O5(g)=4NO2(g)+O2(g)△H=+56.76kJ/mol,自发进行的原因是( )
|
| A. | 是吸热反应 | B. | 是放热反应 |
|
| C. | 是熵减少的反应 | D. | 熵增大效应大于能量效应 |
| 焓变和熵变. | |
| 专题: | 化学平衡专题. |
| 分析: | 由反应2N2O5(g)=4NO2(g)+O2(g)△H=+56.76kJ/mol,可知该反应吸热,且熵值增大,根据△G=△H﹣T•△S判断,反应能自发进行,必须满足=△H﹣T•△S<0才可. |
| 解答: | 解:反应能否自发进行取决于焓变和熵变的综合判据,在反应2N2O5(g)=4NO2(g)+O2(g)△H=+56.76kJ/mol,可知该反应吸热,且熵值增大, 根据△G=△H﹣T•△S判断,反应能自发进行,必须满足△H﹣T•△S<0才可,即熵增大效应大于能量效应. 故选D. |
| 点评: | 本题考查焓变和熵变,题目难度不大,本题注意反应能否自发进行,不取决于焓变或熵变中的一种,而是二者的综合判据,当△H﹣T•△S<0时,反应才能自发进行. |


科目:高中化学 来源: 题型:
下列关于化学反应限度的说法中正确的是( )
A.改变外界条件不能改变化学反应的限度
B.当某反应在一定条件下达到反应限度时即达到了化学平衡状态
C.当某反应体系中气体的压强不再改变时,该反应一定达到反应限度
D.当某反应达到限度时,反应物和生成物的浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物X的分子式为C3H6O2.X在酸性条件下与水反应,生成的有机物Y和Z.Y在铜催化下被氧化为W,Z和W能发生银镜反应.
(1)X和Z的名称为:X ,Z .
(2)写出下列反应的化学方程式:
Y与浓硫酸的混合物共热发生消去反应 ,W与新制Cu(OH)2、NaOH混合溶液共热发生的反应 .
查看答案和解析>>
科目:高中化学 来源: 题型:
2008年10月8日,美籍华裔科学家钱永健获得2008年度诺贝尔化学奖.16岁时,他凭借一个金属易受硫氰酸盐腐蚀的调查项目,荣获“美国西屋科学天才奖”.下列叙述正确的是( )
|
| A. | 金属腐蚀就是金属失去电子被还原的过程 |
|
| B. | 将水库中的水闸(钢板)与外加直流电源的负极相连,正极连接到一块废铁上可防止水闸被腐蚀 |
|
| C. | 合金的熔点都高于它的成分金属,合金的耐腐蚀性也都比其成分金属强 |
|
| D. | 铜板上的铁铆钉处在潮湿的空气中直接发生反应:Fe﹣3e﹣=Fe3+,继而形成铁锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:
把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol•L﹣1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如图的坐标曲线来表示,下列推论错误的是( )
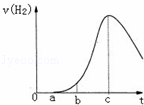
|
| A. | t由0→a段不产生氢气是因为表面的氧化物隔离了铝和硫酸溶液 |
|
| B. | t由b→c段产生氢气的速率增加较快的主要原因之一是温度升高 |
|
| C. | t>c产生氢气的速率降低主要是因为溶液中c(H+)降低 |
|
| D. | t=c时反应处平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是氯碱工业中应用的立式隔膜电解槽示意图,其中的离子膜仅允许阳离子通过.下列说法正确的是( )
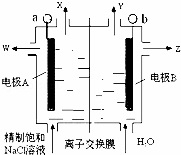
|
| A. | 加入的H2O可用稀NaCl溶液代替,以增加导电能力 |
|
| B. | W是稀的氯化钠溶液 |
|
| C. | OH﹣从阴极区向阳极区移动 |
|
| D. | b电极反应式:2Cl﹣﹣2e﹣=Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
一种光化学电池的结构如图所示,电池总反应为AgCl(s)+
Cu+(aq)====Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法中正确的是 ( )
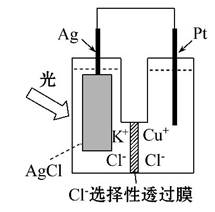
A.Cl-由负极迁移到正极
B.负极上物质发生还原反应
C.Cu+在负极发生氧化反应
D.生成108 g银,转移电子个数为1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,0.2 mol/L的一元酸.HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
A.HA为强酸
B.该混合液pH=7
C.图中X表示HA,Y表示OH-,Z表示H+
D.该混合溶液中:c(A-)+c(Y) =c(Na+)
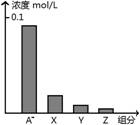
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com