
【题目】工业上采用CO2与NH3为原料合成尿素[CO(NH2)2],反应原理为:
①2NH3 +CO2=H2NCOONH4; ②H2NCOONH4=CO(NH2)2 + H2O
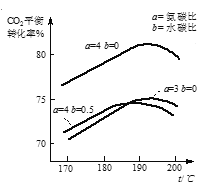
(1)将一定量![]() =3的原料气通入合成塔中,在分离出的气体中测得
=3的原料气通入合成塔中,在分离出的气体中测得![]() =6,则该反应中CO2的转化率(CO2转化率=
=6,则该反应中CO2的转化率(CO2转化率=![]() ×100%)为______。
×100%)为______。
(2)合成中氨碳比[![]() ]、水碳比[
]、水碳比[![]() ]以及反应的温度对CO2的平衡转化率的影响如图,则该反应最适宜的条件是:氨碳比为______,反应温度为______。
]以及反应的温度对CO2的平衡转化率的影响如图,则该反应最适宜的条件是:氨碳比为______,反应温度为______。
(3)实验室用以下装置模拟第一步反应合成H2NCOONH4(氨基甲酸铵)的实验。
已知:H2NCOONH4遇水易发生非氧化还原反应,生成碳酸铵或碳酸氢铵。
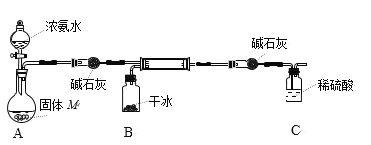
①装置A用于制备氨气,则固体M可以是______或______。
②反应中若有水存在,写出生成碳酸氢铵反应的化学方程式______。
③选用干冰提供CO2的优点是______。装置C为吸收尾气的装置,导管未插入液面以下的目的是______。
【答案】75% 4 190~195℃(或190~195℃任意值) 碱石灰 CaO CO2+NH3+H2O=NH4HCO3(或写成H2NCOONH4 +H2O=NH4HCO3+NH3) 快速简便的制备CO2(或保证参与反应的CO2无水) 防止倒吸
【解析】
(1)由![]() 的起始量和分离出的量计算反应消耗的二氧化碳的量,再由转化率公式计算既得;
的起始量和分离出的量计算反应消耗的二氧化碳的量,再由转化率公式计算既得;
(2)由图可知,氨碳比为4、反应温度在190~195℃范围时,CO2的平衡转化率最大;
(3)由实验装置图可知,装置A用浓氨水与氧化钙固体或氢氧化钠固体或碱石灰反应制备氨气,并用盛有碱石灰的干燥管干燥氨气;装置B用干冰升华制备干燥二氧化碳气体;二氧化碳气体和氨气在硬质玻璃管中反应生成氨基甲酸铵,为防止氨基甲酸铵水解,用盛有碱石灰的干燥管吸收二氧化碳,并防止水蒸气进入硬质玻璃管中;用盛有稀硫酸的洗气瓶吸收过量的氨气,防止污染环境。
(1)若起始n(CO2)为1mol,则n(NH3)为3mol,设消耗n(CO2)为xmol,由方程式可知分离出的气体中![]() =
=![]() =6,解得x=0.75mol,则的转化率为
=6,解得x=0.75mol,则的转化率为![]() ×100%=75%,故答案为:75%;
×100%=75%,故答案为:75%;
(2)由图可知,氨碳比为4、反应温度在190~195℃范围时,CO2的平衡转化率最大,故答案为:4;190~195℃(或190~195℃任意值);
(1)①装置A用浓氨水与氧化钙固体或氢氧化钠固体或碱石灰反应制备氨气,故答案为:碱石灰;CaO;
②反应中若有水存在,氨气、二氧化碳和水反应生成碳酸氢铵,或反应生成的氨基甲酸铵发生水解反应生成碳酸氢铵,反应的化学方程式为CO2+NH3+H2O=NH4HCO3或H2NCOONH4 +H2O=NH4HCO3+NH3,故答案为:CO2+NH3+H2O=NH4HCO3(或写成H2NCOONH4 +H2O=NH4HCO3+NH3);
③装置B用干冰升华快速简便制备干燥二氧化碳气体;若导管未插入液面下,氨气与稀硫酸反应会产生倒吸,故答案为:快速简便的制备CO2(或保证参与反应的CO2无水);防止倒吸。


 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:
【题目】酸性KMnO4在生产、生活、卫生医疗中常用作消毒剂,高锰酸钾造成的污渍可用还原性的草酸(H2C2O4 )去除,Fe(NO3)3也是重要氧化试剂,下面是对这两种氧化剂性质的探究。
(1)取300 mL 0.2 mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则转移电子的物质的量的是________mol。
(2)测定KMnO4样品的纯度可用标准Na2S2O3溶液进行滴定,取0.395 g KMnO4样品溶解酸化后,用0.100 mol/L标准Na2S2O3溶液进行滴定,标准Na2S2O3溶液应盛装在________(填“酸式”或“碱式”)滴定管中。实验中,滴定至终点时消耗Na2S2O3溶液12.50 mL,则该样品中KMnO4的质量分数是________。(有关离子方程式为:8MnO4-+5S2O32-+14H+=8Mn2++10SO42-+7H2O)
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色。溶液先变为浅绿色的离子方程式是_______________,又变为棕黄色的离子方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质。下列说法错误的是( )
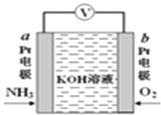
A. 溶液中K+向电极b移动
B. 氨气在电极a上发生氧化反应
C. 反应消耗的NH3与O2的物质的量之比为4:3
D. 正极的电极反应式为:O2+4e-+2H2O=4OH-,故反应一段时间后,电解液的pH升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲学生用如1图所示装置证明溴和苯的反应是取代反应而不是加成反应,主要实验步骤如下:
(1)检查装置的气密性,然后向烧瓶中加入一定量的苯和液溴。
(2)向锥形瓶中加入适量某液体,小试管中加入CCl4,并将右边的长导管口浸入CCl4液面下。
(3)将A装置中的纯铁丝小心向下插入混合液中。
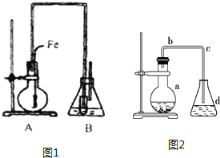
请填写下列空白:
①根据课本所学知识:苯是平面型分子(所有原子共平面),甲烷是正四面体型分子,由此推测![]() 中最多______个原子共平面。
中最多______个原子共平面。
②装置B的锥形瓶中小试管内CCl4的作用是_______;小试管外的液体是________。
③反应后,向锥形瓶B中滴加______,现象是___________________。
④乙同学使用图2装置,a中加入一定量的苯,液溴,铁屑,d中液体仍与图1B中小试管外液体相同,后续操作仍然为③,用此装置证明溴和苯的反应是取代反应而不是加成反应,甲认为乙同学的实验不严密,试说明不严密的理由______________。
⑤写出苯与液溴反应的化学方程式____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A. 向0.1 molL-1CH3COOH溶液中加入少量水,溶液中 减小
减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中  增大
增大
C. 向盐酸中加入氨水至中性,溶液中 >1
>1
D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3溶液中 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如图所示。A是生活中常用的调味品,B是常见的无色液体。气体C是空气的主要成分之一,I的溶液常用作漂白剂。气体H的水溶液显碱性。J的摩尔质量是32g·mol-1,且与H所含元素种类相同。

回答下列问题:
(1)C的结构式是_____,I的化学式是_____。
(2)反应①的离子方程式是______。
(3)反应②的化学方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g) ![]() 2Z(g) ΔH<0。当改变某个条件并达到新平衡后,下列叙述正确的是( )
2Z(g) ΔH<0。当改变某个条件并达到新平衡后,下列叙述正确的是( )
A. 升高温度,X的体积分数减小
B. 增大压强(缩小容器体积),Z的浓度不变
C. 保持容器体积不变,充入一定量的惰性气体,Y的浓度不变
D. 保持容器体积不变,充入一定量的Z,X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像中的曲线(纵坐标为沉淀或气体的量,横坐标为加入物质的量),其中错误的是

A. 图A表示向含H+、Mg2+、Al3+、NH4+的溶液中滴加NaOH溶液产生沉淀量的关系曲线
B. 图B表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线
C. 图C表示向NaOH和Na2CO3的混合液中滴加盐酸产生CO2气体的关系曲线
D. 图D表示向明矾溶液中滴加Ba(OH)2溶液产生沉淀量的关系曲线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com