


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
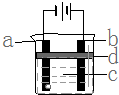 由于Fe (OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe (OH)2沉淀,应用如图电解实验可以制得白色的纯净的Fe (OH)2沉淀.两电极材料分别为石墨和铁.
由于Fe (OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe (OH)2沉淀,应用如图电解实验可以制得白色的纯净的Fe (OH)2沉淀.两电极材料分别为石墨和铁.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
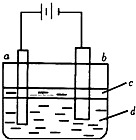 由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.
由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省浙北名校联盟高三上学期期中联考化学试卷(解析版) 题型:实验题
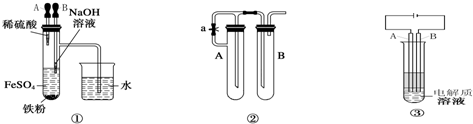
由于氢氧化亚铁在空气中能迅速被氧气氧化成氢氧化铁,因此要观察到氢氧化亚铁的颜色往往较为困难。某研究性学习小组的同学经过讨论后,设计出了三套能较长时间观察Fe(OH)2沉淀颜色的装置,如图。
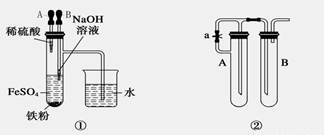
1.根据装置①,要想达到实验目的,应先挤胶头滴管_______(填“A”或“B”)
2.利用装置②,所用试剂为NaOH溶液、铁屑、稀硫酸,
(1)试管A中加入的试剂是_________试管B中加入的试剂是_______
(2)为了制得Fe(OH)2白色沉淀,现准备进行如下操作:先向试管A和B中加入试剂,然后_____(“打开”或“关闭”)止水夹,塞紧塞子,接下来的实验步骤是____________________
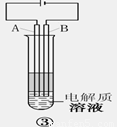
3.装置③时利用电解原理来达到实验目的的。
(1)电极材料是铁棒(Fe)和碳棒(C),A极应为_______(填材料的元素符号)
(2)电解质溶液可选用__________(填选项序号)
A.NaCl溶液 B.CuSO4溶液 C.Na2SO4溶液 D.NaOH溶液
(3)该实验准备选用一种有机物来起到隔绝空气的作用,该有机物可以是__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com