
| A. | 只有① | B. | 只有②③⑤ | C. | 只有⑤ | D. | 全部 |
分析 ①臭氧空洞主要与氟氯代烃等过量排放造成;
②光化学烟雾的形成主要是汽车尾气排放出的氮氧化物发生复杂的变化造成的;
③主要是水体富营养化导致水中的藻类生长繁殖过快所引起的;
④白色污染主要是由白色塑料等引起的;
⑤引起酸雨的主要气体是二氧化硫、二氧化氮等气体;
⑥造成温室效应的气体是二氧化碳.
解答 解:①“臭氧空洞”主要是大量使用氟氯代烃等引起的,故正确;
②“光化学烟雾”主要是由NO2等引起的,能引起人的呼吸道疾病,故正确;
③赤潮主要是由水体中P、N等元素过量引起的,造成水体富营养化,故正确;
④“白色污染”主要是由白色塑料等引起的,如聚乙烯、聚苯乙烯塑料,故正确;
⑤酸雨的主要形成原因是因为过度使用含硫化石燃料,SO2过度排放造成,故错误;
⑥“温室效应”主要是由空气中CO2浓度增大引起的,故正确;
故选C.
点评 本题主要考查了常见的环境污染,明确形成环境污染的原因,可以让学生了解形成实质,懂得保护环境,节约能源.


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:解答题
 氨、硫、氯及其化合物对环境有着重要的影响,在化工生产和日常生活中的用途也十分广泛,如用做漂白剂、沉淀剂、农药、化肥等.
氨、硫、氯及其化合物对环境有着重要的影响,在化工生产和日常生活中的用途也十分广泛,如用做漂白剂、沉淀剂、农药、化肥等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间 物质 | 0 min | 10 min | 30 min | 60 min | 70 min |
| CO2(mol/L) | 0 | 0.2 | 0.6 | 0.8 | 0.8 |
| CH3OH(mol/L) | 1.0 | 0.8 | 0.4 | 0.2 | 0.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 一段时间后Zn电极逐渐溶解 | |
| B. | 该装置中Cu极为正极,发生还原反应 | |
| C. | b极反应的电极反应式为:H2-2e-=2H+ | |
| D. | 电流方向:a电极→ →Cu电极 →Cu电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
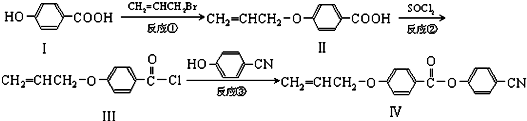
 .
. 也可与III发生类似反应③的反应,生成有机物V,V的结构简式是
也可与III发生类似反应③的反应,生成有机物V,V的结构简式是 .
.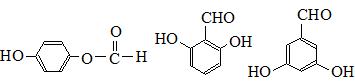 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 0.25mol | C. | 3.01×1023个 | D. | 1mol |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:选择题
对于苯乙烯( )有下列叙述:① 能使酸性KMnO4溶液褪色;② 能使溴的四氯化碳溶液褪色;③ 可溶于水;④ 可溶于苯中;⑤ 能与浓硝酸发生取代反应;⑥ 所有的原子可能共平面。其中正确的是( )
)有下列叙述:① 能使酸性KMnO4溶液褪色;② 能使溴的四氯化碳溶液褪色;③ 可溶于水;④ 可溶于苯中;⑤ 能与浓硝酸发生取代反应;⑥ 所有的原子可能共平面。其中正确的是( )
A.①②③④⑤ B.①②⑤⑥ C.①②④⑤⑥ D.全部正确
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com