
分析 X标况下密度为4.6g/L,X的相对分子量为:4.6g/L×22.4L/mol=103g/mol,一定条件下X完全分解可得到两种双原子气体单质混合物,此时气体物质的量变为原来的2倍,所以X是二氧化二氯,反应方程式为:Cl2O2=Cl2+O2;Fe2+和酸性KMnO4溶液反应的离子5Fe2+~KMnO4,而18.00mL 0.020mol/L的酸性KMnO4溶液的物质的量为:18.00×10-3L×0.020mol/L=3.6×10-4mol,所以消耗亚铁的物质的量5×3.6×10-4mol=1.8×10-3mol,所以与17.15mg的X气体的物质的量为:$\frac{17.15×1{0}^{-3}g}{103g/mol}$=1.67×10-4mol,反应消耗酸性(NH4)2Fe(SO4)2的物质的量为:0.080mol/L×35×10-3L-1.8×10-3mol=1×10-3mol,所以n(Cl2O2):n(Fe2+)=1:6,所以反应的离子方程式为Cl2O2+6Fe2++4H+=6Fe3++2Cl-+2H2O,由此分析解答.
解答 解:X标况下密度为4.6g/L,X的相对分子量为:4.6g/L×22.4L/mol=103g/mol,一定条件下X完全分解可得到两种双原子气体单质混合物,此时气体物质的量变为原来的2倍,所以X是二氧化二氯,反应方程式为:Cl2O2=Cl2+O2;Fe2+和酸性KMnO4溶液反应的离子5Fe2+~KMnO4,而18.00mL 0.020mol/L的酸性KMnO4溶液的物质的量为:18.00×10-3L×0.020mol/L=3.6×10-4mol,所以消耗亚铁的物质的量5×3.6×10-4mol=1.8×10-3mol,所以与17.15mg的X气体的物质的量为:$\frac{17.15×1{0}^{-3}g}{103g/mol}$=1.67×10-4mol,反应消耗酸性(NH4)2Fe(SO4)2的物质的量为:0.080mol/L×35×10-3L-1.8×10-3mol=1×10-3mol,所以n(Cl2O2):n(Fe2+)=1:6,所以反应的离子方程式为Cl2O2+6Fe2++4H+=6Fe3++2Cl-+2H2O,
(1)X气体的化学式为Cl2O2,故答案为:Cl2O2;
(2)Fe2+和酸性KMnO4溶液反应的离子5Fe2+~KMnO4,而18.00mL 0.020mol/L的酸性KMnO4溶液的物质的量为:18.00×10-3L×0.020mol/L=3.6×10-4mol,所以消耗亚铁的物质的量5×3.6×10-4mol=1.8×10-3mol,所以与17.15mg的X气体的物质的量为:$\frac{17.15×1{0}^{-3}g}{103g/mol}$=1.67×10-4mol,反应消耗酸性(NH4)2Fe(SO4)2的物质的量为:0.080mol/L×35×10-3L-1.8×10-3mol=1×10-3mol,所以n(Cl2O2):n(Fe2+)=1:6,所以反应的离子方程式为Cl2O2+6Fe2++4H+=6Fe3++2Cl-+2H2O,故答案为:Cl2O2+6Fe2++4H+=6Fe3++2Cl-+2H2O;
(3)与X组成元素相同的另一种气体Y是国际上公认为安全、无毒的绿色消毒剂,它与X相比少一个A原子,则Y是二氧化氯,二氧化氯能与许多化学物质发生爆炸爆炸反应,对光、热、震动、撞击和摩擦相当敏感,易分解发生爆炸,所以氢气不能稀释,而与有机物相遇则促进氧化而爆炸,所以甲烷不稀释,故选BC;
(4)二氧化氯氧化CN-生成CO2和N2,反应离子方程式2CN-+2 ClO2=2CO2+N2+2 Cl-,故答案为:2CN-+2 ClO2=2CO2+N2+2 Cl-.
点评 本题考查无机物的推断,题目难度较大,注意根据元素守恒和常见物质的性质和存在进行推断,解题的关键是X物质确定,注意根据物质的量的关系确定反应方程式的书写.


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:选择题
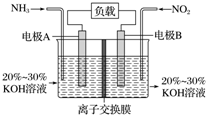 利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,下列说法不正确的是( )
利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,下列说法不正确的是( )| A. | 电子从右侧电极经过负载后流向左侧电极 | |
| B. | 为使电池持续放电,离子交换膜需选用阴离子交换膜 | |
| C. | 电极A极反应式为2NH3-6e-+6OH-═N2+6H2O | |
| D. | 当有4.48 L NH3 (标准状况)反应时,转移电子为0.6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该原子的摩尔质量是aNA | |
| B. | Wg该原子的物质的量一定是$\frac{W}{a{N}_{A}}$mol | |
| C. | Wg该原子中含有$\frac{W}{a}$个该原子 | |
| D. | 由已知信息可得:NA=$\frac{12}{b}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相对分子质量 M=$\frac{22.4mw}{[(1-w)V]}$ | B. | 物质的量浓度 c=$\frac{1000dV}{(MV+22.4m)}$ | ||
| C. | 溶质的质量分数 w=$\frac{MV}{22.4m}$ | D. | 溶液密度 d=$\frac{cM}{1000w}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何条件下,等物质的量的甲烷和一氧化碳所含的分子数一定相等 | |
| B. | 同温同压下,相同体积的物质,其物质的量一定相等 | |
| C. | 1L一氧化碳气体一定比1L氧气的质量小 | |
| D. | 一氧化碳气体和氮气,若体积相等,则质量一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶质水解反应:HCO3-+H2O?H3O++CO32- | |
| B. | 离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| C. | 微粒浓度关系:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | 微粒浓度关系:c(OH-)+c(CO32-)=c(H+)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠与水反应:Na+H2O═Na++H2 | |
| B. | 氯化铵溶液显酸性的原因:NH4++H2O═NH3•H2O+H+ | |
| C. | AICl3溶液中加入足量氨水:Al3++4NH3•H2O═AlO2-+4NH4+2H2O | |
| D. | 氯化铁溶液中滴加少量的硫化氢溶液:2Fe3++H2S═2Fe2++S+2H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com