
【题目】从粗铜精炼的阳极泥(主要含有Cu2Te)中提取粗碲的一种工艺流程如图:(已知TeO2微溶于水,易溶于强酸和强碱) 下列有关说法正确的是

A. “氧化浸出”时为使碲元素沉淀充分,应加入过量的硫酸
B. “过滤”用到的玻璃仪器:分液漏斗、烧杯、玻璃棒
C. “还原”时发生的离子方程式为2SO32-+Te4++4OH-=Te↓+2SO42-+2H2O
D. 判断粗碲洗净的方法:取少量最后一次洗涤液,加入BaCl2溶液,没有白色沉淀生成
【答案】D
【解析】
A.由题中信息可知,TeO2微溶于水,易溶于强酸和强碱,是两性氧化物。Cu2Te与硫酸、氧气反应,生成硫酸铜和TeO2,硫酸若过量,会导致TeO2的溶解,造成原料的利用率降低,故A错误;
B.“过滤”用到的玻璃仪器:漏斗、烧杯、玻璃棒,故B错误;
C.Na2SO3加入到Te(SO4)2溶液中进行还原得到固态碲,同时生成Na2SO4,该反应的离子方程式是2SO32-+Te4 ++2H2O=Te↓+2SO42-+4H+,故C错误;
D.通过过滤从反应后的混合物中获得粗碲,粗碲表面附着液中含有SO42-,取少量最后一次洗涤液,加入BaCl2溶液,若没有白色沉淀生成,则说明洗涤干净,故D正确。
故选D。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】镁一空气电池是一种能被水激活的一次性储备电池,原理如图所示。下列说法错误的是

A. 放电时,外电路电子由镁电极流向多孔碳材料电极
B. 放电时,正极的电极反应式为O2+ 4e—+ 2H2O =4OH
C. 理论上,外电路中流过2 mol电子时,负极质量增加58 g
D. 电池反应产物Mg(OH)2经过灼烧与还原可制成镁锭循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘:
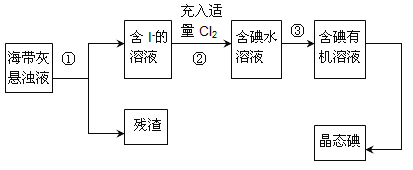
(1)指出提取碘的过程中有关的实验操作名称:①________,③________;
(2)操作③中所用的有机试剂可以是________;
A.乙醇 B.四氯化碳 C.乙酸 D.汽油
(3)已知操作步骤②中得到的“含碘水溶液中有Cl-离子存在,写出该步骤的离子反应:___________________________________________;
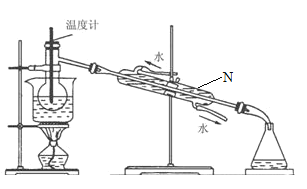
(4)从含碘的有机溶液中提取碘和回收有机溶液,还需要经过蒸馏,观察如图所示实验装置,指出仪器N的名称是:________________________,装置中有典型两处错误,加以改正:①________________________,②_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.常温下,0.1 mol/L Na2S溶液中存在:c(OH﹣)=c(H+)+c(HS﹣)+c(H2S)
B.0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:C(Na+)>c(CO32-)>c(HCO3- )>c(OH-) >c(H+)
C.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
D.向0.1 mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH﹣)/c(NH3·H2O)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用如下装置(夹持和加热仪器已略去)电解饱和食盐水,并检验氯气的氧化性,同时用电解产生的H2还原CuO粉末来测定Cu的相对原子质量。

(1)写出电解饱和食盐水的离子方程式_________________________________。
(2)为完成上述实验,正确的连接顺序为A连_______;B连_______ (填写导管口字母)。
(3)若检验氯气的氧化性,则乙装置的a瓶中溶液可以是下列试剂中的___________。
a.酸性高锰酸钾溶液 b.淀粉碘化钾溶液 c.亚硫酸钠溶液 d.氯化亚铁溶液
(4)丙装置的c瓶中盛放的试剂为___________,作用是______________________。
(5)为测定Cu的相对原子质量,设计了如下甲、乙两个实验方案:
精确测量硬质玻璃管的质量为a g,放入CuO后,精确测量硬质玻璃管和CuO的总质量为b g(假设CuO充分反应),实验完毕后:
甲方案:通过精确测量硬质玻璃管和Cu粉的总质量为c g,进而确定Cu的相对原子质量。
乙方案:通过精确测定U型管b反应前后的质量变化,得到生成水的质量d g,进而确定Cu的相对原子质量。
①请你分析并回答:___________方案所测结果更准确。若按合理方案测定的数据计算,Cu的相对原子质量为________________。
②不合理的方案会造成测定结果___________(填“偏低、偏高或无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2、NO是大气污染物,NH4NO3、H2SO4等是水体污染物,有效去除这些污染物是一项重要课题。
(1)NO、SO2可以先氧化,后用碱吸收。其氧化过程的反应原理如下:
NO(g)+O3(g)NO2(g)+O2(g) H1=-200.9kJ/mol
SO2(g)+O3(g) SO3(g)+O2(g) H2=-241.6kJ/mol
2SO2(g)+O2(g) 2SO3(g) H3=-196.6kJ/mol
则反应2NO2(g) 2NO(g)+O2(g)的H=___kJ/mol
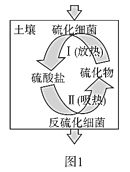
(2)土壤中的硫循环如图1所示。
①土壤中的黄铁矿(FeS2)在过程I中会转化成硫酸亚铁和硫酸。该过程发生反应的化学方程式为_____;
②某种反硫化细菌在过程II中需要有乳酸参与反应消耗硫酸生成H2S并伴有热量放出,那么乳酸除在反应中作还原剂外,还存在另一作用,请解释原因:_____;
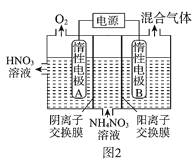
(3)电解法除去工业废水中的硝酸铵的装置示意图如图2所示,阴极电极反应式为____;
(4)向恒容密闭容器中充入1molNO和2molO3,发生如下反应:NO(g)+O3(g) NO2(g)+O2(g) △H<0不同温度下反应相同时间后,体系中NO转化率随温度变化曲线如图3。温度低于100℃时,NO转化率随温度升高而增大的主要原因是_____;当温度高于100℃时,NO转化率随温度升高而降低,原因是_____。
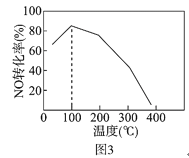
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下.某同学进行CO2与Na2O2反应的探究实验(本实验所涉及气体休积均在相同状况下测定)。请回答下列问题:
(1)用下图装置制备纯净的CO2.
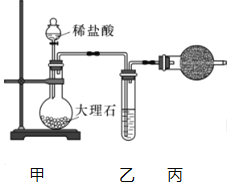
①丙装置的名称是_______,乙装置中盛装的试剂是_______.
②若CO2中混有HCl,则HCl与Na2O2发生反应的化学方程式为_________。
(2)按下图所示装置进行实验(夹持装置略)。
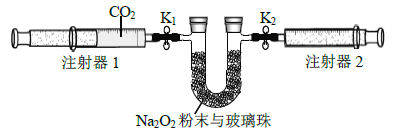
①先组装仪器.然后________.再用注射器1抽取100 mL纯净的CO2,将其连接在K1处,注射器2的活塞推到底后连接在K2处,具支U形管中装入足量的Na2O2粉末与玻璃珠。
②打开止水夹K1、K2,向右推动注射器1的活塞。可观察到的现象是________。
③实验过程中.需缓慢推入CO2,其目的是__________.为达到相同目的,还可进行的操作是__________________________。
(3)实验结束后,当注射器1的活塞推到底时,测得注射器2中气体的体积为65 mL。则CO2的转化率是_______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示有关物质之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物(反应条件图中已省略)
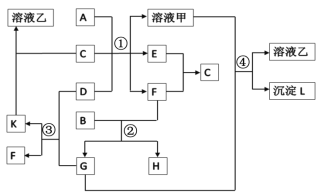
(1)A,D代表的物质分别为:________,________(填化学式);
(2)反应①中的C,D均过量,该反应的化学方程式是____________________________________;
(3)反应②中,若B与F物质的量之比为4∶3,G,H分别是_______,_______(填化学式);其物质的量之比为__________.
(4)反应③产物中K的化学式为____________;④的离子方程式为_____________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,其变化可表述为:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
(1)浓盐酸在反应中显示出来的性质是__________(填编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(2)产生0.3mol Cl2,则转移的电子的物质的量为__________mol。
(3)氧化剂是__________,氧化产物是__________。
(4)![]() ,该反应的还原产物是__________;_________元素被氧化;若反应有
,该反应的还原产物是__________;_________元素被氧化;若反应有![]() 电子发生转移,则被还原的氧化剂是_________mol。
电子发生转移,则被还原的氧化剂是_________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com