
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:_______与盐酸反应最剧烈,______与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计_______(填“合理”或“不合理”),说明理由:___________。
Ⅱ.利用下图装置可以验证非金属性的变化规律。
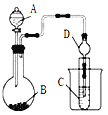
(3)仪器A的名称为_________,干燥管D的作用是________________。
(4)实验验证氯的非金属性大于硫:A中放浓盐酸、B中放KMnO4、C中盛放__________(填写试剂名称),C中反应的离子方程式为____________________。从环境保护的观点考虑,此装置缺少尾气处理装置,可用____________溶液吸收尾气。
(5)若要证明非金属性:C>Si,则A中加盐酸、B中加Na2CO3、C中加__________,观察到C中溶液的现象为___________________________________。有同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有____________溶液的洗气瓶。
【答案】钾 铝 不合理 因为一水合氨不是最高价氧化物对应的水化物 分液漏斗 防止倒吸 硫化钠溶液(其他答案合理也可) Cl2+ S2- =S + 2Cl- 氢氧化钠 硅酸钠溶液 出现白色胶状物质 饱和碳酸氢钠溶液
【解析】
Ⅰ. (1)金属越活泼,反应速度越快,反应越剧烈;
(2)判断碱性强弱时,利用最高价氧化物对应的水化物进行判断;
Ⅱ. (3)根据装置图判断仪器名称和仪器的作用;
(4)A中浓盐酸与B中高锰酸钾反应生成氯气,在C中加入硫化钠溶液后,Cl2可将S2-氧化为S单质,据此可验证氯的非金属性大于硫;发生的离子方程式为:Cl2+S2-=S+2Cl-;尾气中过量的Cl2可用NaOH进行吸收;
(5)A中盐酸与B中Na2CO3反应生成CO2,CO2通入硅酸钠溶液中可得难溶的硅酸,利用强酸制弱酸原理可得结论。
Ⅰ. (1)金属越活泼,反应速度越快,反应越剧烈,三种金属中金属钾最活泼,金属性最强,因此钾与盐酸反应最剧烈;三种金属中金属铝最不活泼,金属性最弱,因此铝与盐酸反应最慢;
(2) 判断碱性强弱时,利用最高价氧化物对应的水化物进行判断,因NH3·H2O不是最高价氧化物对应的水化物,因此不能进行比较,该设计不合理;
Ⅱ. (3)由装置图可知仪器A为分液漏斗;干燥管D可用于防止倒吸;
(4) A中浓盐酸与B中高锰酸钾反应生成氯气,在C中加入硫化钠溶液后,Cl2可将S2-氧化为S单质,由此可知Cl2的氧化性强于S,即可知氯的非金属性大于硫;
(5) A中盐酸与B中Na2CO3反应生成CO2,CO2通入硅酸钠溶液中可得难溶的硅酸,由此可知C中加入的物质为硅酸钠溶液,观察到的现象为出现白色胶状物质;为了防止挥发出的HCl干扰实验,可在两装置间添加装有饱和碳酸氢钠溶液的洗气瓶。
金属性比较 | 本质 | 原子越易失电子,金属性越强(与原子失电子数目无关) |
判断方法 | ①在金属活动性顺序表中越靠前,金属性越强 | |
②单质与水或非氧化性酸反应越剧烈,金属性越强 | ||
③单质还原性越强或阳离子氧化性越弱,金属性越强 | ||
④最高价氧化物对应水化物的碱性越强,金属性越强 | ||
⑤若Xn++Y―→X+Ym+,则Y比X的金属性强 | ||
⑥元素在周期表中的位置:左边或下方元素的金属性强 | ||
非金属性比较 | 本质 | 原子越易得电子,非金属性越强(与原子得电子数目无关) |
判断方法 | ①与H2化合越容易,气态氢化物越稳定,非金属性越强 | |
②单质氧化性越强或阴离子还原性越弱,非金属性越强 | ||
③最高价氧化物对应水化物的酸性越强,非金属性越强 | ||
④元素在周期表中的位置:右边或上方元素的非金属性强 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】欲配制0.18 molL-1 醋酸钠溶液500mL,可采用以下两种方案:
方案一:用托盘天平称取______g无水醋酸钠,溶于适量水中,配成500mL溶液。定容时若仰视容量瓶刻度线,则所配制结果将______![]() 填“偏大”“偏小”或“无影响”
填“偏大”“偏小”或“无影响”![]() 。
。
方案二:用体积均为250mL且浓度均为______ molL-1的醋酸与氢氧化钠两溶液混合而成(设混合后的体积等于混合前两者体积之和)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖由约翰·B·古迪纳夫、M·斯坦利·威廷汉、吉野彰三人分获,以表彰他们研究锂离子电池做出的贡献。锂离子正极材料有LiMO2(M=Co、Ni、Mn) .
回答下列问题:
(1)基态Co原子价电子排布式为______,基态Li原子核外电子运动状态有____种。
(2)锂离子电池电解常用的锂盐有LiClO4、LiBF4等,常采用有机溶剂有乙醚、丙烯酯(![]() )等。
)等。
①LiClO4中阴离子空间构型为______,与其键合方式相同、空间构型也相同的离子和分子是___________________________ (各举一例).
②Li、Cl、F、B的电负性从大到小的顺序为_____;丙烯碳酸酯中碳原子的杂化方式是____。
③C2H5OC2H5(乙醚)的沸点比乙醇的低,其原因是________________。
(3)LiCoO2的晶胞是六棱柱,其结构如图所示:

晶胞中含氧原子数为_____,若晶胞的底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,则LiCoO2的密度为_______g·cm —3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验结果不能作为相应定律或原理的证据之一的是(阿伏加德罗定律:在同温同压下,相同体积的任何气体含有相同数目的分子)
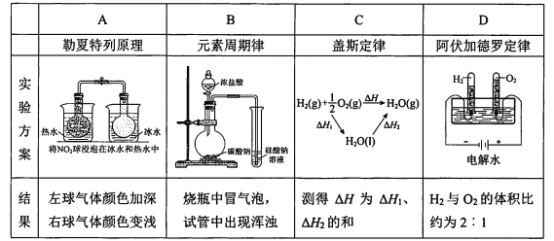
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是
A. 糖类、油脂、蛋白质在一定条件下均能水解
B. 乙二醇、苯乙烯在一定条件下均可聚合生成高分子化合物
C. 分子式为C4H8C12的有机物共有(不含立体异构)8种
D. ![]() 处于同一平面上的原子数最多为18个
处于同一平面上的原子数最多为18个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某苯的衍生物,含有两个互为对位的取代基,其分子式为C8H10O,其中不溶解于NaOH溶液的该衍生物的结构式有( )
A.1种B.2种C.3种D.4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理来解释的是
A. 开启啤酒瓶后,瓶中马上泛起大量泡沫
B. 红棕色的NO2,加压后颜色先变深后变浅
C. 含酚酞的氨水溶液,微热后红色变深
D. H2(g)、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.增大压强或升高温度,—定能使化学反应速率加快
B.合成氨工业中,将氨气液化分离来可以提高正反应速率和产率
C.500°C、30 MPa下,0.5 mol N2(g)和1.5mol H2(g)反应生成NH3(g) 放热QkJ,其热化学方程式为N2(g)+3 H2(g) ![]() 2 NH3(g) △H=-2QkJ/mol
2 NH3(g) △H=-2QkJ/mol
D.己知两个平衡体系:2NiO(s) ![]() 2Ni(s)+O2(g) 2CO(g)+O2(g)
2Ni(s)+O2(g) 2CO(g)+O2(g) ![]() 2CO2(g)是平衡常数分别为K1和K2,可推知平衡NiO(s)+CO(g)
2CO2(g)是平衡常数分别为K1和K2,可推知平衡NiO(s)+CO(g) ![]() Ni(s)+CO2(g)的平衡常数为
Ni(s)+CO2(g)的平衡常数为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com