
分析 气态烃对空气的相对密度是1.93,则烃的相对分子质量为1.93×29=56,1.68g烃的物质的量为$\frac{1.68g}{56g/mol}$=0.03mol,燃烧得到5.28g CO2和0.15mol水,计算C、H原子的物质的量可确定有机物分子式,并确定可能的结构.
解答 解:气态烃对空气的相对密度是1.93,则烃的相对分子质量为1.93×29=56,1.68g烃的物质的量为$\frac{1.68g}{56g/mol}$=0.03mol,
n(CO2)=$\frac{5.28g}{44g/mol}$=0.12mol,同时生成0.15mol水,
则有机物含有C原子数为$\frac{0.12mol}{0.03mol}$=4,含有H原子数为$\frac{0.15mol}{0.03mol}×2$=10,
所以分子式为C4H10,
对应的结构简式有CH3CH2CH2CH3、CH3CH(CH3)2,
答:该气态烃的分子式为C4H10,所有可能的结构简式为CH3CH2CH2CH3、CH3CH(CH3)2.
点评 本题考查有机物分子式的确定,为高频考点,侧重于学生的分析、计算能力的考查,注意相对密度的运用,为解答该题的关键,难度不大.


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 分子中一定含有化学键 | |
| B. | 共价化合物一定不含有离子键 | |
| C. | 含有金属元素的离子一定是阳离子 | |
| D. | 非金属元素的化合物一定不含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
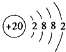 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
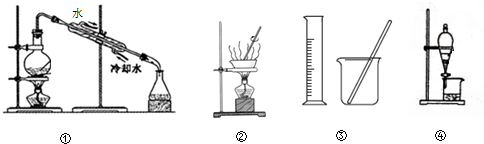
| A. | 用①分离NaCl溶液和NaOH溶液 | |
| B. | 用②蒸干NH4Cl和饱和溶液获取NH4Cl晶体 | |
| C. | 用③配制100mL 0.1000mol•L-1 K2Cr2O2溶液 | |
| D. | 用④分离Na2CO3溶液和CH3COOC2H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| C(Fe3+)/mol•L-1 | c(I-)/mol•L-1 | v/mol•L-1•s-1 | |
| ① | 0.80 | 0.20 | 0.032k |
| ② | 0.40 | 0.60 | 0.144k |
| ③ | 0.20 | 0.80 | 0.128k |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
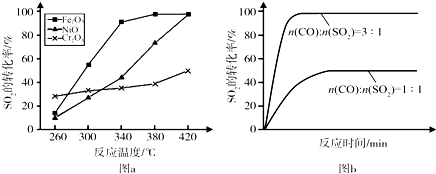
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
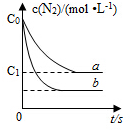 等物质的量的N2(g)和O2(g)在恒容密闭容器中反应:N2(g)+O2(g)?2NO(g),下图曲线a表示该反应在T℃时N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.下列叙述正确的是( )
等物质的量的N2(g)和O2(g)在恒容密闭容器中反应:N2(g)+O2(g)?2NO(g),下图曲线a表示该反应在T℃时N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.下列叙述正确的是( )| A. | T℃时,该反应的平衡常数K=$\frac{4({c}_{0}-{c}_{1})^{2}}{{{c}_{1}}^{2}}$ | |
| B. | T℃时,随着反应的进行,混合气体的密度减小 | |
| C. | 曲线b对应的条件改变可能是加入了催化剂 | |
| D. | 若曲线b对应的条件改变是温度,可判断该反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3a+b-c | B. | c-3a-b | C. | a+b-c | D. | c-a-b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com