
【题目】下列离子组在一定条件下能共存,当加入相应试剂后会发生化学变化,且所给离子方程式正确的是( )
选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
A | Fe2+、NO | 稀硫酸 | 3Fe2++NO |
B | Fe3+、I-、ClO- | 氢氧化钠溶液 | Fe3++3OH-===Fe(OH)3↓ |
C | Ba2+、HCO | 氢氧化钠溶液 | HCO |
D | Al3+、Cl-、NO | 过量氢氧化钠溶液 | Al3++3OH-===Al(OH)3↓ |
科目:高中化学 来源: 题型:
【题目】向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示。则下列说法中正确的是
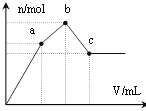
A. a点的溶液呈中性
B. 从开始到b点发生反应的总的离子方程式是:Al3++2SO42-+2Ba2++3OH-= Al(OH)3↓+2BaSO4↓
C. c点加入Ba(OH)2溶液的体积为200 mL
D. c点溶液呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率和限度的说法不正确的是( )
A. 实验室用H2O2分解制O2,加MnO2做催化剂后,反应速率明显加快
B. 在金属钠与足量水反应中,增加水的量能加快反应速率
C. 2SO2+O2![]() 2SO3反应中,SO2的转化率不能达到100%
2SO3反应中,SO2的转化率不能达到100%
D. 实验室用锌和盐酸反应制取氢气,用锌粉比锌粒反应要快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铜锌原电池(如图所示)的说法正确的是
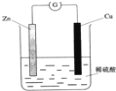
A. Zn是负极,发生还原反应 B. Cu是负极,发生氧化反应
C. 铜片上有气体逸出 D. 电子由铜片通过导线流向锌片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修5:有机化学基础]
聚对苯二甲酸丁二醇酯(PBT)是一种性能优异的热塑性高分子材料。PBT的一种合成路线如图所示:
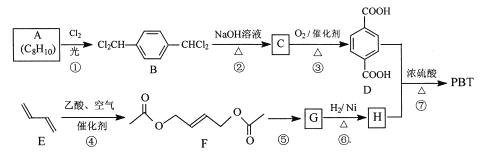
回答下列问题:
(1)A的结构简式是_________,C的化学名称是_________。
(2)⑤的反应试剂和反应条件分别是__________。
(3)F的分子式是_________,⑥的反应类型是_________。
(4)⑦的化学方程式是_________。
(5)M是H的同分异构体,同时符合_列条件的M可能的结构有_________种。
a.0.1 molM与足量金属钠反应生成氢气2.24 L(标准状况)
b.同一个碳原子上不能连接2个羟基
其中核磁共振氢谱显不3组峰,且峰而积之比为3:1:1的结构简式是_________。
(6)以2一甲基-1-3一丁二烯为原料(其它试剂任选),设计制备![]() 的合成路线:_________
的合成路线:_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L密闭容器中充入4molA气体和3molB气体,发生下列反应:2A(g)+B(g) ![]() C(g)+xD(g),5s达到平衡。达到平衡时,生成了1mol C,测定D的浓度为1mol/L。
C(g)+xD(g),5s达到平衡。达到平衡时,生成了1mol C,测定D的浓度为1mol/L。
(1)求x =____。
(2)求这段时间A的平均反应速率为_____。
(3)平衡时B的浓度为______。
(4)下列叙述能说明上述反应达到平衡状态的是_____
A 单位时间内每消耗2 mol A,同时生成1molC
B 单位时间内每生成1molB,同时生成1mol C
C D的体积分数不再变化
D 混合气体的压强不再变化
E B、C的浓度之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,饱和NaCl溶液的密度为ρ g·cm3,物质的量浓度为c mol/L,则下列说法中不正确的是
A. 温度低于20 ℃时,饱和NaC1溶液的浓度小于c mol/L
B. 此溶液中NaCl的质量分数为(58.5×c/ρ×1000)×100%
C. 将1 L该NaCl溶液蒸干可好到58.5c gNaCl固体
D. 20℃时,NaCl的溶解度S=(5850c/(ρ58.5))g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a和b是组成物质种类最多的元素,c是地壳中含量最多的元素,d与b同族,e2+离子的3d轨道中有9个电子。回答下列问题:
(1)c、d两种元素形成的化合物统称硅石,可通过______________方法区分其结晶形和无定形的两种存在形态,c的电子排布图为_______________________。
(2)A和B是生活中两种常见的有机物,A能与CaCO3反应,可用于厨房除水垢;B分子中的碳原子数目与A中相同,可发生银镜反应。A中存在化学键的类型是______;
A.离子键 B.极性键 C.非极性键 D.σ键 E.π键
B分子官能团中碳原子的轨道杂化类型是____。
(3)用“>”或“<”填空:
第一电离能 | 熔点 |
b___d | dc2晶体___d晶体 |
(4)c与e两种元素可形成一种半导体材料,化学式为e2c,在其立方晶胞内部有四个c原子,其余c原子位于面心和顶点,则该晶胞中有____个e原子,e元素位于元素周期表的_______区。
(5)向e2+硫酸盐的水溶液中加入过量的氨水,可得到深蓝色透明溶液,加入乙醇可析出深蓝色晶体,请书写析出晶体的离子方程式___________________。
(6)e单质为面心立方晶体,其原子半径为rcm,其晶胞棱长为a nm,则e单质的密度为__________g·cm-3,其空间利用率的计算式为_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com