
某兴趣小组以苯和乙烯为主要原料,采用以下路线合成药物普鲁卡因:





请回答下列问题:
(1)对于普鲁卡因,下列说法正确的是________(填选项字母)。
A.可与浓盐酸形成盐
B.不与氢气发生加成反应
C.可发生水解反应
D.能形成内盐
(2)写出化合物B的结构简式___________________________________。
(3)写出B→C反应所需的试剂________。
(4)写出C+D→E的化学反应方程式___________________________。
(5)写出同时符合下列条件的B的所有同分异构体的结构简式_____________________________________________________________。
①分子中含有羧基
②1H—NMR谱显示分子中含有苯环,且苯环上有两种不同化学环境的氢原子
(6)通常采用乙烯为原料制得环氧乙烷后与X反应合成D,请用化学反应方程式表示以乙烯为原料制备X的合成路线(无机试剂任选)。
解析 采用逆向推理法:

(1)由普鲁卡因的结构简式可知,其分子中含有—NH2,能与盐酸反应生成盐;分子中含有苯环,可与H2加成;分子中含有酯基,能发生水解反应;因分子中只有碱性基团,而无酸性基团,故不能形成盐。综上分析,A、C项正确。

(6)结合信息:由D[(CH3CH2)2NCH2CH2OH]可逆推X为(CH3CH2)2NH,由原料CH2===CH2,可推断另一种反应物为NH3。CH2===CH2与NH3在一定条件下分步发生反应,其化学方程式为CH2===CH2+HCl―→CH3CH2Cl、2CH3CH2Cl+NH3―→NH(CH2CH3)2+2HCl。
答案 (1)AC



科目:高中化学 来源: 题型:
在下列反应中:A2(g)+B2(g)2AB(g) ΔH<0当其达到平衡时,在下图所示的曲线中,符合勒夏特列原理的是( )
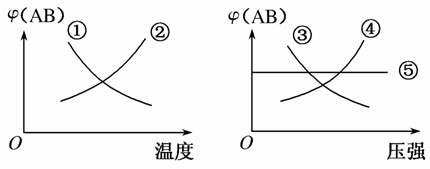
A.①② B.③④
C.① D.①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生活、社会密切相关。下列说法正确的是
A.光纤通信使用的光缆的主要成分是晶体Si,太阳能电池使用的材料主要是SiO2
B.氨很容易液化,液氨气化吸收大量的热,所以液氨常用作制冷剂
C.高锰酸钾溶液、酒精、双氧水都能杀菌消毒,消毒原理相同,都利用了强氧化性
D.SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等
查看答案和解析>>
科目:高中化学 来源: 题型:
写出下列反应的离子方程式:
(1)CO2气体溶于足量NaOH溶液。
(2)NaHCO3溶液与盐酸反应。
(3)少量NaOH溶液滴入Ca(HCO3)2溶液中。
(4)足量NaOH溶液滴入Ca(HCO3)2溶液中。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学在生产和日常生活中有着重要的应用。下列说法不正确的是( )
A.明矾水解形成的Al(OH)3胶体能吸附水中的悬浮物,可用于水的净化
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C.MgO的熔点很高,可用于制作耐高温材料
D.电解MgCl2饱和溶液,可制得金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
关于下图所示装置的判断,叙述正确的是( )

A.左边的装置是电解池,右边的装置是原电池
B.该装置中铜为正极,锌为负极
C.当铜片的质量变化为12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L
D.装置中电子的流向是:a→Cu→经过CuSO4溶液→Zn→b
查看答案和解析>>
科目:高中化学 来源: 题型:
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。请回答下列问题:
(1)工业上采用电解氧化铝—冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝:
2Al2O3 4Al+3O2↑
4Al+3O2↑
加入冰晶石的作用:____①____。

(2)上述工艺所得铝材中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为________②________,下列可作阴极材料的是____③____。
A.铝材 B.石墨
C.铅板 D.纯铝
(3)阳极氧化能使金属表面生成致密的氧化膜。以稀硫酸为电解液,铝阳极发生的电极反应式为____④________。
(4)在铝阳极氧化过程中,需要不断地调整电压,理由是____⑤________。
(5)下列说法正确的是____⑥____。(填选项字母)
A.阳极氧化是应用原电池原理进行金属材料表面处理的技术
B.铝的阳极氧化可增强铝表面的绝缘性能
C.铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
D.铝的阳极氧化膜富有多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
从淡化海水中提取溴的流程如图所示,下列有关说法错误的是( )
A.X为SO2气体,也可将SO2换成Na2SO3
B.设备Y为蒸馏塔
C.在提取溴的过程中一定有Br-被氧化
D.工业上每获得1molBr2,需要消耗Cl2的体积最多为22.4L(标准状态)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com