
A、
| ||
B、
| ||
C、
| ||
D、
|
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| 物质 | X | Y | Z |
| 初始浓度/mol/L | 0.1 | 0.2 | 0 |
| 平衡浓度/mol/L | 0.05 | 0.05 | 0.1 |
| A、反应达到平衡时,X的转化率为50% |
| B、反应可表示为X+3Y?2Z,其平衡常数为1 6 |
| C、增大压强使平衡向生成Z的方向移动,平衡常数增大 |
| D、改变温度可以改变此反应的平衡常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(E) |
| c(OH-) |
| c(H+) |
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.48倍,则m+n>p+q | ||
| B、若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n | ||
| C、若平衡体系共有气体a mol,再向其中加入b mol B,当重新达到平衡时,气体的总物质的量等于(a+b),则m+n=p+q | ||
D、温度不变时,若压强增大至原来的2倍,达到新平衡时,总体积一定比原体积的
|
查看答案和解析>>
科目:高中化学 来源: 题型:
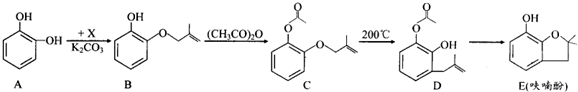
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、①和④代表的有机物都能与溴发生加成反应 |
| B、②和③代表的有机物都能发生取代反应和氧化反应 |
| C、用酸性高锰酸钾溶液可以除去有机物⑤中混有的有机物① |
| D、②和③代表的有机物所含官能团与葡萄糖相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁片改为铁粉 |
| B、稀硫酸改为98% 浓硫酸 |
| C、对该反应体系加热 |
| D、铁片改为锌片 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com