
关于工业合成氨的叙述中,错误的是( )
A.在动力、设备、材料允许的情况下,反应尽可能在高压下进行
B.温度越高越有利于工业合成氨
C.在工业合成氨中N2、H2的循环利用可提高其利用率,降低成本
D.及时从反应体系中分离出氨气有利于平衡向正反应方向移动
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
有FeO、Fe2O3的混合物若干克,在足量H2气流中加热充分反应,冷却后称得剩余固体比原混合物减轻0.8g;将等质量的原混合物与盐酸反应,欲使之完全溶解, 至少需要1mol•L﹣1的盐酸的体积为( )
A. 0.05 L B. 0.1 L C. 0.2 L D. 1 L
查看答案和解析>>
科目:高中化学 来源: 题型:
在相同温度下,0.01 mol·L-1 NaOH溶液和0.01 mol·L-1的盐酸相比,下列说法正确的是( )
A.由水电离出的[H+]相等
B.由水电离出的[H+]都是1.0×10-12 mol·L-1
C.由水电离出的[OH-]都是0.01 mol·L-1
D.两者都促进了水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
中学阶段介绍的应用电解法制备的物质主要有三种:一是铝的工业制备、二是氯碱工业、三是金属钠或镁的制备。下列关于这三个工业生产的描述中正确的是( )
A.电解法制镁时一般是电解熔融态的氯化镁,但也可用其相应的盐,如熔融态的碳酸镁
B.电解法生产铝时,需对铝土矿进行提纯,在提纯过程中应用了氧化铝或氢氧化铝的两性
C.在氯碱工业中,电解池中的阴极产生的是H2,NaOH在阳极附近产生
D.氯碱工业和金属钠的冶炼都用到了NaCl,在电解时它们的阴极都是Cl-失电子
查看答案和解析>>
科目:高中化学 来源: 题型:
在硫酸工业中,通过下列反应使SO2氧化成SO3:
2SO2(g)+O2(g)
 2SO3(g) ΔH=-198 kJ·mol-1。(已知制SO3过程中催化剂是V2O5,它在400℃~500℃时催化效果最好)
2SO3(g) ΔH=-198 kJ·mol-1。(已知制SO3过程中催化剂是V2O5,它在400℃~500℃时催化效果最好)
下表为不同温度和压强下SO2的转化率(%):
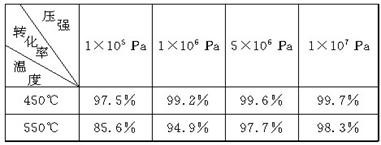
(1)根据化学理论综合分析,为了使二氧化硫尽可能转化为三氧化硫,可控制的条件是________________________________________________________________________。
(2)实际生产中,选定400℃~500℃作为操作温度,其原因是
________________________________________________________________________。
(1) 实际生产中,采用的压强为常压,其原因是
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(2) 在生产中,通入过量空气的目的是
________________________________________________________________________
________________________________________________________________________。
(5)尾气中有SO2,必须回收是为了
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
现向含AgBr的饱和溶液中:
(1)加入固体AgNO3,则[Ag+]________(填“变大”、“变小”或“不变”,下同);
(2)加入更多的AgBr固体,则[Ag+]________;
(3)加入AgCl固体,则[Br-]________,[Ag+]________;
(4)加入Na2S固体,则[Br-]________,[Ag+]________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子的物质的量为
( )
A.0.1 mol B.0.2 mol C.0.3 mol D.0.4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如右图,下列说法不正确的是( )。
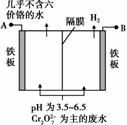
A.A接电源正极
B.阳极区溶液中发生的氧化还原反应为Cr2O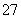 +6Fe2++14H+===2Cr3++6Fe3++7H2O
+6Fe2++14H+===2Cr3++6Fe3++7H2O
C.阴极区附近溶液pH降低
D.若不考虑气体的溶解,当收集到H2 13.44 L(标准状况)时,有0.1 mol Cr2O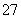 被还原
被还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com