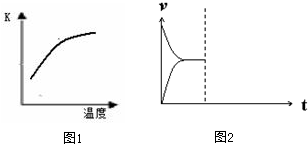
解:(1)平衡常数K与温度的关系可知,升高温度,平衡常数K增加,即平衡向正反应方向移动,所以正反应方向是吸热方向,所以a<0,故答案为:<;
(2)A.当反应达到平衡时,混合气体的总的物质的量不变,总质量不变,所以容器中气体的平均分子量不随时间而变化,故A正确;
B.无论反应是否达到平衡状态,v(N
2)/v(O
2)=2:3,所以当反应达到平衡时,v(N
2)/v(O
2)=2:3,故B正确;
C.当反应达到平衡时,混合气体的总质量不变,容器的体积不变,容器中气体的密度不随时间而变化,故C正确;
D.通入稀有气体,反应物的浓度不变,反应速率不变,故D错误;
故选:ABC;
(3)A.由NH
3.H
2O

OH
-+NH
4+可知,K
b=

,K
W=C(H
+)?C(OH
-),所以

=

×

=

×

,而温度不变,电离平衡常数不变,水的离子积不变,溶液中随着水量的增加,由NH
3.H
2O

OH
-+NH
4+可知,n(OH
-)增大,n(NH
4+)增大,且两者相等,所以

不变,故A错误;
B.该式子是电离平衡常数表达式,温度不变,电离平衡常数不变,故B错误;
C.温度不变,水的离子积不变,故C错误;
D.温度不变,水的离子积不变,当稀释氨水时,溶液中氢氧根的浓度减小,氢离子的浓度增加,所以

增大,故D正确;
故答案为:D;
(4)4)在恒压密闭容器中上述反应达到平衡后,在其他条件不变时,通入2mol N
2,容器的体积扩大,N
2的浓度增大,生成物的浓度减小,即V
正增大,V
逆减小,最终相等,图象为:

,故答案为:

.
分析:(1)根据温度对化学平衡的影响分析;
(2)当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生变化,由此衍生的一些物理性不变,以此解答该题.
(3)根据电离平衡常数、溶液中各微粒的浓度分析;
(4)在恒压密闭容器中上述反应达到平衡后,在其他条件不变时,通入2mol N
2,容器的体积扩大,N
2的浓度增大,生成物的浓度减小,
点评:本题考查化学平衡的移动、化学平衡、弱电解质的电离等,明确稀释时电离平衡的移动及离子的物质的量、离子的浓度的变化是解答的关键,并注意离子积与温度的关系来解答.

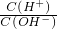
 OH-+NH4+可知,Kb=
OH-+NH4+可知,Kb= ,KW=C(H+)?C(OH-),所以
,KW=C(H+)?C(OH-),所以 =
= ×
× =
= ×
× ,而温度不变,电离平衡常数不变,水的离子积不变,溶液中随着水量的增加,由NH3.H2O
,而温度不变,电离平衡常数不变,水的离子积不变,溶液中随着水量的增加,由NH3.H2O OH-+NH4+可知,n(OH-)增大,n(NH4+)增大,且两者相等,所以
OH-+NH4+可知,n(OH-)增大,n(NH4+)增大,且两者相等,所以 不变,故A错误;
不变,故A错误; 增大,故D正确;
增大,故D正确; ,故答案为:
,故答案为: .
.

 阅读快车系列答案
阅读快车系列答案

 。设在容积为2.0 L的密 闭容器中充人0. 60 mol N2(g)和l.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。计算
。设在容积为2.0 L的密 闭容器中充人0. 60 mol N2(g)和l.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。计算  的平衡常数。
的平衡常数。