
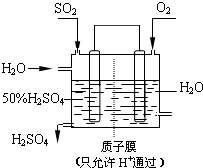
 工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤.
工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤.| 1 |
| 2 |
 SO2(g)+
SO2(g)+| 1 |
| 2 |
| 1 |
| 2 |
 SO3(g);△H=-98kJ?mol-1,
SO3(g);△H=-98kJ?mol-1, SO2(g)+
SO2(g)+| 1 |
| 2 |
c(SO2)×
| ||
| c(SO3) |
0.02×
| ||
| 0.02 |


科目:高中化学 来源: 题型:
| A、硫酸氢钠溶液和过量的Ba(OH)2溶液反应:SO42-+H++Ba2++OH-═BaSO4↓+H2O |
| B、氧化铁溶于氢碘酸:Fe2O3+6H+═2Fe3++3H2O |
| C、过氧化钠固体与水反应:2O22-+2H2O═4OH-+O2↑ |
| D、将1mol?L-1的NaAlO2溶液和2.5mol?L-1的HCl溶液等体积均匀混合:AlO2-+H++H2O═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X的非金属性比Y的强 |
| B、X和W组成的化合物化学性质活泼,与盐酸和氢氧化钠溶液都能反应 |
| C、Y的气态氢化物不如Z的气态氢化物稳定 |
| D、某溶液中通入Z的单质,再滴加淀粉溶液显蓝色,原溶液中一定含有I- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、葡萄糖银镜反应实验后的试管内壁附有银,可用氨水清洗 |
| B、酸碱中和滴定时,未用待测液润洗锥形瓶,对测定结果无影响 |
| C、向某溶液中加入足量盐酸无现象,再加入BaCl2溶液生成白色沉淀说明有SO42- |
| D、在无色溶液中先加入氯水、再加入CCl4,振荡静置,下层溶液显红棕色说明有Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
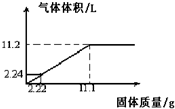 将Mg和Al粉末均匀混合,加入到100mL某浓度的硫酸中,产生氢气的体积(标准状况下)与加入粉末的质量关系如图所示:
将Mg和Al粉末均匀混合,加入到100mL某浓度的硫酸中,产生氢气的体积(标准状况下)与加入粉末的质量关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com