
【题目】A、B、C、D、E、F、G、H八种前四周期元素,原子序数依次增大,A、B、F三者原子序数之和为25,且知B、F同主族,![]() 与G的气态氢化物的水溶液反应生成
与G的气态氢化物的水溶液反应生成![]() 氢气
氢气![]() 标准状况下
标准状况下![]() ,
,![]() 和E的离子具有相同的电子层结构,工业上用电解元素B和E能形成离子化合物的方法冶炼E单质,H元素常温下遇浓硫酸钝化,其一种核素质量数56,中子数30。试判断并回答下列问题:
和E的离子具有相同的电子层结构,工业上用电解元素B和E能形成离子化合物的方法冶炼E单质,H元素常温下遇浓硫酸钝化,其一种核素质量数56,中子数30。试判断并回答下列问题:
![]() 该元素在周期表中的位置__________ .
该元素在周期表中的位置__________ .
![]() 由F、G二种元素形成化合物
由F、G二种元素形成化合物![]() 的电子式______,含有化学键的类别为___________.
的电子式______,含有化学键的类别为___________.
![]() 、C、F形成的最简单气态氢化物沸点由低到高的顺序依次为________
、C、F形成的最简单气态氢化物沸点由低到高的顺序依次为________![]() 用化学式表示
用化学式表示![]()
![]() 由A、B、D、F四种元素可以组成两种盐,写出这两种盐反应的离子方程式__________
由A、B、D、F四种元素可以组成两种盐,写出这两种盐反应的离子方程式__________
![]() 在碱性条件下,G的单质可与
在碱性条件下,G的单质可与![]() 反应制备一种可用于净水的盐
反应制备一种可用于净水的盐![]() ,该反应的离子方程式是_______.
,该反应的离子方程式是_______.
![]() 熔融盐燃料电池用熔融的碳酸盐作为电解质,负极充入燃料气
熔融盐燃料电池用熔融的碳酸盐作为电解质,负极充入燃料气![]() ,用空气与
,用空气与![]() 的混合气作为正极的助燃气,以石墨为电极材料,制得燃料电池。写出充入
的混合气作为正极的助燃气,以石墨为电极材料,制得燃料电池。写出充入![]() 的一极发生反应的电极反应式______。
的一极发生反应的电极反应式______。
![]() 利用上述燃料电池,按图1所示装置进行电解,A、B、C、D均为铂电极,
利用上述燃料电池,按图1所示装置进行电解,A、B、C、D均为铂电极,

Ⅰ![]() 甲槽电解的是
甲槽电解的是![]() 一定浓度的NaCl与
一定浓度的NaCl与![]() 的混合溶液,理论上两极所得气体的体积随时间变化的关系如图2所示
的混合溶液,理论上两极所得气体的体积随时间变化的关系如图2所示![]() 气体体积已换算成标准状况下的体积,电解前后溶液的体积变化忽略不计
气体体积已换算成标准状况下的体积,电解前后溶液的体积变化忽略不计![]() 。
。![]() 的物质的量浓度为________
的物质的量浓度为________![]() 。
。
Ⅱ![]() 乙槽为
乙槽为![]() 溶液,通电一段时间,当C极析出
溶液,通电一段时间,当C极析出![]() 物质时停止通电,若使乙槽内的溶液完全复原,可向乙槽中加入________
物质时停止通电,若使乙槽内的溶液完全复原,可向乙槽中加入________![]() 填字母
填字母![]() 。
。
A ![]()
![]()
![]()
![]()
![]() 若通电一段时间后,向所得的乙槽溶液中加入
若通电一段时间后,向所得的乙槽溶液中加入![]() 的
的![]() 才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为________。
才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为________。
【答案】第四周期第ⅧA族;  极性共价键、非极性共价键
极性共价键、非极性共价键 ![]() 、HF、
、HF、![]()
![]() ;
; ![]()
![]()
![]()
![]()
![]()
【解析】
A、B、C、D、E、F、G、H八种前四周期元素,原子序数依次增大,![]() 与G的气态氢化物的水溶液反应生成
与G的气态氢化物的水溶液反应生成![]() 氢气
氢气![]() 标准状况下
标准状况下![]() ,则E为Al,G为Cl,
,则E为Al,G为Cl,![]() 和E的离子具有相同的电子层结构,则D为Na,工业上用电解氧化铝方法冶炼铝单质,所以B为O,B、F同主族,则F是硫,A、B、F三者原子序数之和为25,则A是氢,C的原子序数大于氧、小于钠,故C为氟,H元素常温下遇浓硫酸钝化,其一种核素质量数56,中子数30,则H为Fe。
和E的离子具有相同的电子层结构,则D为Na,工业上用电解氧化铝方法冶炼铝单质,所以B为O,B、F同主族,则F是硫,A、B、F三者原子序数之和为25,则A是氢,C的原子序数大于氧、小于钠,故C为氟,H元素常温下遇浓硫酸钝化,其一种核素质量数56,中子数30,则H为Fe。
A、B、C、D、E、F、G、H八种前四周期元素,原子序数依次增大,![]() 与G的气态氢化物的水溶液反应生成
与G的气态氢化物的水溶液反应生成![]() 氢气
氢气![]() 标准状况下
标准状况下![]() ,则E为Al,G为Cl,
,则E为Al,G为Cl,![]() 和E的离子具有相同的电子层结构,则D为Na,工业上用电解氧化铝方法冶炼铝单质,所以B为O,B、F同主族,则F是硫,A、B、F三者原子序数之和为25,则A是氢,C的原子序数大于氧、小于钠,故C为氟,H元素常温下遇浓硫酸钝化,其一种核素质量数56,中子数30,则H为Fe。
和E的离子具有相同的电子层结构,则D为Na,工业上用电解氧化铝方法冶炼铝单质,所以B为O,B、F同主族,则F是硫,A、B、F三者原子序数之和为25,则A是氢,C的原子序数大于氧、小于钠,故C为氟,H元素常温下遇浓硫酸钝化,其一种核素质量数56,中子数30,则H为Fe。
![]() 是Fe,在元素周期表中的位置是第四周期第ⅧA族,故答案为:第四周期第ⅧA族;;
是Fe,在元素周期表中的位置是第四周期第ⅧA族,故答案为:第四周期第ⅧA族;;
![]() 由F、G二种元素形成化合物
由F、G二种元素形成化合物![]() 的电子式为
的电子式为 ;含有化学键的类别为极性共价键、非极性共价键;故答案为:
;含有化学键的类别为极性共价键、非极性共价键;故答案为: ;极性共价键、非极性共价键;
;极性共价键、非极性共价键;
![]() 、C、F形成的最简单气态氢化物分别是
、C、F形成的最简单气态氢化物分别是![]() 、HF、
、HF、![]() ;HF、
;HF、![]() 常温下为气体,HF分子之间存在氢键,沸点高于
常温下为气体,HF分子之间存在氢键,沸点高于![]() ,水常温下为液态,沸点最高,故沸点由低到高的顺序是
,水常温下为液态,沸点最高,故沸点由低到高的顺序是![]() 、HF、
、HF、![]() ;故答案为:
;故答案为:![]() 、HF、
、HF、![]() ;
;
![]() ①四种元素要形成酸式盐,阳离子只能为
①四种元素要形成酸式盐,阳离子只能为![]() ,阴离子只能为亚硫酸氢根或硫酸氢根,写离子方程式时亚硫酸氢钠拆分为钠离子和亚硫酸氢根,硫酸氢钠拆分为钠离子、氢离子和硫酸根,等式两端抵消掉某些离子后,离子方程式为:
,阴离子只能为亚硫酸氢根或硫酸氢根,写离子方程式时亚硫酸氢钠拆分为钠离子和亚硫酸氢根,硫酸氢钠拆分为钠离子、氢离子和硫酸根,等式两端抵消掉某些离子后,离子方程式为:![]() ;
;
②在碱性条件下,G的单质![]() 可与
可与![]() 反应制备一种可用于净水的盐
反应制备一种可用于净水的盐![]() ,该反应的离子方程式是
,该反应的离子方程式是![]() ;
;
故答案为:![]() ;
;![]() ;
;
![]() 负极发生氧化反应,所以
负极发生氧化反应,所以![]() 的一极发生反应的电极反应式
的一极发生反应的电极反应式![]() ;故答案为:
;故答案为:![]() ;
;
![]() Ⅰ
Ⅰ![]() 电解200mL一定浓度的NaCl与
电解200mL一定浓度的NaCl与![]() 混合溶液,阳极发生
混合溶液,阳极发生![]() 、
、![]() ,阴极发生
,阴极发生![]() 、
、![]() ,结合图可知,a为阴极气体体积与时间的关系,b为阳极气体体积与时间的关系,由图可知,产生氯气为224mL,
,结合图可知,a为阴极气体体积与时间的关系,b为阳极气体体积与时间的关系,由图可知,产生氯气为224mL,![]() ,
,![]() 时生成氧气为112mL,
时生成氧气为112mL,![]() ,则共转移电子为
,则共转移电子为![]() ,根据电子守恒及
,根据电子守恒及![]() 可知,
可知,![]() ,所以
,所以![]() ;故答案为:0.1;
;故答案为:0.1;
Ⅱ![]() 根据电极方程式即阳极发生
根据电极方程式即阳极发生![]() ,阴极发生
,阴极发生![]() 。
。
电解过程中损失的元素有铜和氧,A、多加了H元素,错误;B、能够补充铜和氧元素,正确;C、![]() 与硫酸反应放出二氧化碳,相当于加入了氧化铜,正确;
与硫酸反应放出二氧化碳,相当于加入了氧化铜,正确;![]() 多加了H元素,错误;故答案为:BC;
多加了H元素,错误;故答案为:BC;
![]() 加入
加入![]() 相当于加入
相当于加入![]() 和
和![]() ,则电解过程中共转移电子数为
,则电解过程中共转移电子数为![]()
![]() ,数目为
,数目为![]() ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】已知:氯酸钾能氧化Ag、Zn等金属。从一种银矿![]() 含Ag、Zn、Cu、Pb及少量
含Ag、Zn、Cu、Pb及少量![]() 中提取Ag、Cu及Pb的工艺流程如下:
中提取Ag、Cu及Pb的工艺流程如下:
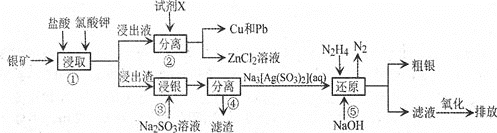
![]() 步骤
步骤![]() 提高矿物中金属离子浸取率除可改变盐酸的浓度和氯酸钾的量,还可采取的措施是________
提高矿物中金属离子浸取率除可改变盐酸的浓度和氯酸钾的量,还可采取的措施是________![]() 写出两种即可
写出两种即可![]() 。
。
![]() 步骤
步骤![]() 试剂X为________
试剂X为________![]() 填化学式,下同
填化学式,下同![]() ;步骤
;步骤![]() 滤渣的成分为________。
滤渣的成分为________。
![]() 步骤
步骤![]() 发生反应的化学方程式为________。
发生反应的化学方程式为________。
![]() 步骤
步骤![]() 发生反应的离子方程式为________;其中
发生反应的离子方程式为________;其中![]() 肼
肼![]() 的电子式为________。
的电子式为________。
![]() 还原后的“滤液”经氧化后,其中的溶质为________。
还原后的“滤液”经氧化后,其中的溶质为________。
![]() 粗银常用电解精炼法提纯,用粗银作阳极,银片作阴极,硝酸银和稀硝酸的混合溶液作电解液,在阴极上有无色气体产生,在液面上方变为红棕色。电解时阴极发生的电极反应为________。
粗银常用电解精炼法提纯,用粗银作阳极,银片作阴极,硝酸银和稀硝酸的混合溶液作电解液,在阴极上有无色气体产生,在液面上方变为红棕色。电解时阴极发生的电极反应为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下面实验装置设计实验制备SO2并进行相关探究活动。

(1)装置A中反应的化学方程式为________________________。
(2)甲同学认为利用上述装置也可证明亚硫酸酸性强于次氯酸,请写出正确的装置连接顺序:A→_________→_________→C→F。
(3)乙同学从上面装置中选择合适的装置验证亚硫酸与碳酸的酸性强弱,其中用到C、D装置。则C装置的作用是________________________,通过______________________现象即可证明亚硫酸酸性强于碳酸。
(4)丙同学将A中产生的足量的SO2通入下图装置G中,G中有白色沉淀生成。该沉淀的化学式为_________。

推测产生沉淀的原因可能是(不考虑空气的影响)
原因一:SO2在酸性条件下被NO3―氧化;
原因二:SO2被Fe3+氧化;
原因三:__________________。
若是原因二,需证明Fe3+的还原产物,其实验操作及现象是________________________。
(5)实验中发现Na2SO3可能部分变质,现需测定Na2SO3的纯度,称15.0 g Na2SO3样品,配成250 mL溶液,取25.00 mL溶液,用0.20 mol·L―1酸性KMnO4溶液进行滴定,达到滴定终点时消耗KMnO4溶液20.00 mL。达到滴定终点时锥形瓶中溶液颜色变化是______________,样品中Na2SO3质量分数是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨N2+3H2![]() 2NH3反应过程中的能量变化如图所示,据图回答下列问题:
2NH3反应过程中的能量变化如图所示,据图回答下列问题:

(1)该反应通常用活性铁作催化剂,加活性铁会使图中B点升高还是降低________________,理由是___________________________________________。
(2)该反应的平衡常数表达式为:K=___________________,当浓度商Qc___K(填“<”、“>”或“=”)时,反应向右进行。
(3)450 ℃时该反应的平衡常数___500 ℃时的平衡常数(填“<”、“>”或“=”)。
(4)一定条件下的密闭容器中,该反应达到平衡,要提高H2的转化率,可以采取的合理措施有___(填字母序号)。
a.高温高压
b.加入催化剂
c.增加N2的浓度
d.增加H2的浓度
e.分离出NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素的单质和化合物很多,利用所学物质结构与性质的知识去认识和理解它们。
(1)溴的核外电子排布式为__。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在。使氢氟酸分子缔合作用力是___。
(3)下列曲线表示卤族元素某种性质随核电荷数递增的变化趋势,正确的是___。
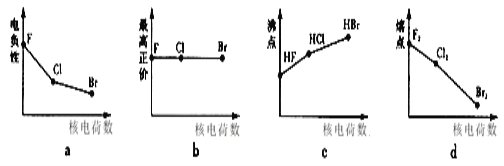
(4)已知高碘酸有两种形式,化学式分别为H5IO6(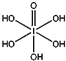 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6___HIO4(填“>”、“<”或“=”)。IO
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6___HIO4(填“>”、“<”或“=”)。IO![]() 的VSEPR模型为__。
的VSEPR模型为__。
(5)铜与氯形成化合物的晶胞如附图所示(黑点代表铜粒子)。

①该晶体的化学式为__。
②一定条件下,Cu2O比CuO更稳定的原因是__。
③已知该晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则该晶体的边长为__pm。(用含ρ、NA的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )

A.原子半径:Z>Y>X
B.气态氢化物稳定性:R<W
C.WX3和水反应生成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是
A.NaHSO4在熔融状态下的电离方程式:NaHSO4=Na++HSO4-
B.H2SO4溶液与NaOH溶液发生中和反应的热化学方程式为(已知H2SO4 溶液与NaOH溶液发生反应的中和热为57.3 kJ/mol):H2SO4(aq)+2NaOH(aq)=2H2O(l)+Na2SO4(aq) △H=-57.3kJ/mol
C.CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D.CaCO3的沉淀溶解平衡方程式:CaCO3(s)=Ca2+(aq)+CO32-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应 X(g)+Y(g)![]() 2Z(g) △H<0,在一定条件下,反应情况如图所示.若使曲线a变为曲线b可采取的措施是
2Z(g) △H<0,在一定条件下,反应情况如图所示.若使曲线a变为曲线b可采取的措施是

A.加入催化剂B.增大压强
C.降低温度D.保持容器体积不变,冲入He气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,向10mL.0.1mol/LCaCl2溶液中滴加0.1mol/L的Na2CO3溶液。滴加过程中溶液中-1gc(Ca2+)与Na2CO3溶液体积(V)的关系如图所示,下列有关说法正确的是( )
(已知1g5=0.7)
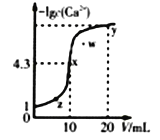
A. x、y两点c(Ca2+)之比为2000:3 B. Ksp(CaCO3)=5×10-9
C. w点对应的分散系很稳定 D. x、y、z三点中,水的电离程度最大的为x点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com