
【题目】在U形管中用惰性电极电解硫酸钠和石蕊的混合液,一段时间后,可以观察到的现象是( )
A. 两极附近颜色无明显变化 B. 两极产生等量气体
C. 阳极附近的颜色变红 D. 阴极附近的颜色变红
科目:高中化学 来源: 题型:
【题目】实验室制乙酸乙酯得主要装置如图中A所示,主要步骤①在a试管中按2:3:2的体积比配制浓硫酸、乙醇、乙酸的混合物;②按A图连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液(加入几滴酚酞试液)中;③小火加热a试管中的混合液;④等b试管中收集到约2mL产物时停止加热.撤下b试管并用力振荡,然后静置待其中液体分层;⑤分离出纯净的乙酸乙酯。
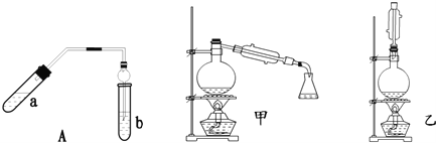
请回答下列问题:
(1)步骤①中,配制这一比例的混合液的正确操作是__;
(2)若实验中用含18O的乙醇与乙酸作用,该反应得化学方程式是:__;
(3)步骤③中,要用小火加热,其原因是__;
(4)步骤④中可观察到b试管中有细小的气泡冒出,写出该反应的离子方程式:__;
(5)A装置中使用球形管除起到冷凝作用外,另一重要作用是__,步骤⑤中分离乙酸乙酯必须使用的一种仪器是__;
(6)为充分利用反应物,甲、乙两位同学分别设计了图中甲、乙两个装置(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物),你认为合理的是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用沉淀滴定法快速测定NaI等碘化物溶液中c(I-),实验过程包括准备标准溶液和滴定待测溶液。
Ⅰ.准备标准溶液
a.准确称取AgNO3基准物4.246 8 g(0.0250 mol)后,配制成250 mL标准溶液,放在棕色试剂瓶中避光保存,备用。
b.配制并标定100 mL 0.100 0 mol·L-1NH4SCN标准溶液,备用。
Ⅱ.滴定的主要步骤
a.取待测NaI溶液25.00 mL于锥形瓶中。
b.加入25.00 mL 0.100 0 mol·L-1AgNO3溶液(过量),使I-完全转化为AgI沉淀。
c.加入NH4Fe(SO4)2溶液作指示剂。
d.用0.100 0 mol·L-1NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,停止滴定。
e.重复上述操作两次。三次测定数据如表:

f.数据处理。
回答下列问题:
(1)将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有________。
(2)滴定应在pH<0.5的条件下进行,其原因是_____________________。
(3)b和c两步操作是否可以颠倒________,说明理由___________________________。
(4)滴定终点的现象为______________________________。测得c(I-)=________ mol·L-1。
(5)判断下列操作对c(I-)测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1~20号元素中A、B、C、D四种元素的原子中,质子数为A<B<C<D,A元素的原子最外层电子数是次外层电子数的2倍;B元素的原子核外M层电子数是L层电子数的一半;C元素的原子次外层电子数比最外层电子数多1个;D元素的原子核外K层。L层电子数之和等于M、N层电子数之和。试推断:
(1)元素B的原子结构示意图_______。
(2)C、D形成的化合物的电子式______。
(3)工业上由A元素的单质制取B元素的单质的化学方程式为____
(4)若没有“质子数为A<B<C<D”的限制,C还可以是____元素。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组的同学在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证哪位同学的判断正确,丙同学设计了图中的实验装置(锌与浓硫酸共热时产生的气体为X,且该反应装置略去)。
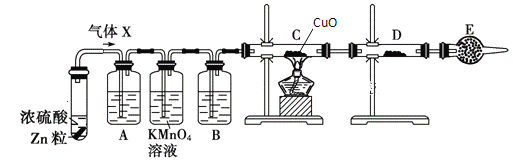
试回答下列问题:
(1)上述反应中生成二氧化硫的化学方程式为_______
(2)A中加入的试剂可能是_____,作用是_____;B中加入的试剂可能是_____,作用是_____;E中加入的试剂可能是_____,作用是_____
(3)可以证明气体X中含有氢气的实验现象:C中______,D中____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PET(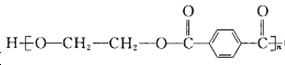 O—CH2CH2OH)可用作食品包装材料,其合成过程中部分副产物可用作合成甲基丙烯酸甲酯,合成路线如下:
O—CH2CH2OH)可用作食品包装材料,其合成过程中部分副产物可用作合成甲基丙烯酸甲酯,合成路线如下:
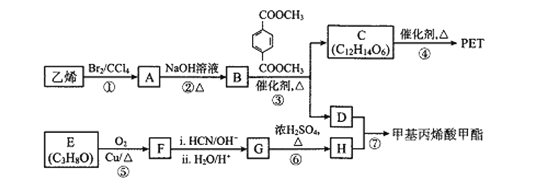
已知:I.RCOOR’+R’’OH ![]() RCOOR’ ’ +R’ OH(R、R’、R’’代表烃基)
RCOOR’ ’ +R’ OH(R、R’、R’’代表烃基)
II.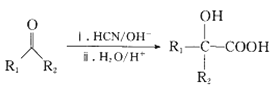 (R1、R2为烃基)
(R1、R2为烃基)
III.F的核磁共振氢谱只有一种峰
回答下列问题:
(1)A的系统命名为_______________;E中官能团的名称为______________。
(2)反应③的反应类型是________;该反应常常需要加热蒸馏出D,结合化学热力学原理分析可能的原因是_______;F的结构简式为_______。
(3)反应④的化学方程式为_______。
(4)反应⑥的化学方程式为_______。
(5)请写出![]() 的所有同分异构体中,满足下列条件的物质的结构简式_________(任写两种)。
的所有同分异构体中,满足下列条件的物质的结构简式_________(任写两种)。
①苯环上的一氯代物只有两种
②苯环上的取代基不超过三个
③红外等光谱显示含2 个-COOH
(6)已知:CH2=CHOH不稳定易转化为CH3CHO;参照上述合成路线,设计以![]() 、CH3OH为原料(无机试剂任选)合成具有强亲水性的滴眼液聚乙烯醇(
、CH3OH为原料(无机试剂任选)合成具有强亲水性的滴眼液聚乙烯醇(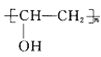 )的路线_______。
)的路线_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应的描述正确的是
A. NaHSO4溶液与Ba(OH)2溶液混合后显中性:Ba2++2OH-+2H++SO![]() ===BaSO4↓+2H2O
===BaSO4↓+2H2O
B. 向Fe2(SO4)3溶液中通入足量Na2S溶液:2Fe3++S2-===2Fe2++S↓
C. 强碱溶液中,用次氯酸钠与Fe(OH)2反应是湿法制备高铁酸钠的最主要过程,可表示为:2ClO-+Fe(OH)2===FeO42—+2Cl-+2H+
D. 将少量二氧化碳通入次氯酸钠溶液中:CO2+H2O+2ClO-===CO32—+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分离提纯主要是利用化学方法的是( )
A.除去粗盐含有的可溶性杂质
B.利用磁铁分离铁屑和沙的混合物
C.利用自来水制备蒸馏水
D.沙里淘金
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com