
硝酸铜是制备Cu——Zn——Al系催化剂的重要原料.19.2g纯铜粉理论上可制得纯净硝酸铜晶体的质量为
[ ]
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 空气 |
| △ |
| HNO3(稀) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、消耗的硝酸的量:③>①>② | B、③对环境造成的危害最小 | C、因铜与浓硝酸作用最快,故制取硝酸铜的最佳方案是① | D、三种途径所消耗的铜的质量不相等 |
查看答案和解析>>
科目:高中化学 来源:2013届湖北省武汉市四校高三10月联考化学试卷(带解析) 题型:填空题
(10分)盐酸、硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。请回答下列问题:
(1)常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有 性。用玻璃棒蘸取浓硫酸滴在纸上,纸逐渐变黑,说明浓硫酸具有 性。
(2)硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,工业上用洗净的废铜屑作原料来制备硝酸铜。下列制备方法符合“绿色化学”思想的是 (填序号)。
① Cu + HNO3(浓)→ Cu(NO3)2 ② Cu + HNO3(稀)→ Cu(NO3)2
③ Cu 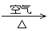 CuO
CuO  Cu(NO3)2
Cu(NO3)2
(3)①在100mL 18mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,测得产生的气体在标准状况下的体积可能是 。
| A.40.32L | B.30.24L | C.20.16L | D.13.44L |
查看答案和解析>>
科目:高中化学 来源:2010年河北省高二9月月考化学试题 题型:选择题
硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,现用以下三种途径来制取相同质量的硝酸铜:①铜与浓硝酸反应;②铜与稀硝酸反应;③铜与氧气反应生成CuO,CuO再与稀硝酸反应。下列有关叙述正确的是
A.消耗的硝酸的量:③>①>②
B.③对环境造成的危害最小
C.因铜与浓硝酸作用最快,故制取硝酸铜的最佳方案是①
D.三种途径所消耗的铜的质量不相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com