
| t�� | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
| c(CO)c(H2O) |
| c(CO2)c(H2) |
| c(CO)c(H2O) |
| c(CO2)c(H2) |
| ʱ��/min | CO2��mol/L�� | H2��mol/L�� | CO��mol/L�� | H2O��mol/L�� |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| c(CO)c(H2O) |
| c(CO2)c(H2) |
| c(CO)c(H2O) |
| c(CO2)c(H2) |
| c(CO)c(H2O) |
| c(CO2)c(H2) |
| C3��C3 |
| (0.2-C3)��(0.3-C3) |
| 0.12mol/L |
| 0.2mol/L |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ���ǵ����Ϻ����ḻ��Ԫ�أ������仯������о���������������������Ҫ���壮
���ǵ����Ϻ����ḻ��Ԫ�أ������仯������о���������������������Ҫ���壮| 1 |
| 2 |
| 3 |
| 2 |
| T/K | 303 | 313 | 323 |
| NH3������/��10-6mol�� | 4.8 | 5.9 | 6.0 |
| C4(NO)C6(H2O) |
| C4(NH3)C5(O2) |
| C4(NO)C6(H2O) |
| C4(NH3)C5(O2) |
| ���� |
| ���¸�ѹ |
| ���� ��� |
��ʼʱ�����ʵ����ʵ���/mol | ��Ӧ��ƽ��ʱ���ʱ�/kJ?mol-1 | ||
| N2 | H2 | NH3 | ||
| A | 1 | 3 | 0 | ��H1=-23.1 |
| B | 0.9 | 2.7 | 0.2 | ��H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
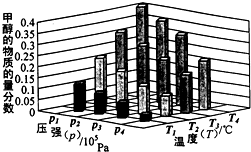 ��Դ����Լ���ҷ�չ���̵�����֮һ���״��������ѵȱ���Ϊ2 1���͵���ɫ��Դ����ҵ��������Ȼ��Ϊ��Ҫԭ���������̼��ˮ������һ���������Ʊ��ϳ�����CO��H2�������Ƴɼ״��������ѣ�
��Դ����Լ���ҷ�չ���̵�����֮һ���״��������ѵȱ���Ϊ2 1���͵���ɫ��Դ����ҵ��������Ȼ��Ϊ��Ҫԭ���������̼��ˮ������һ���������Ʊ��ϳ�����CO��H2�������Ƴɼ״��������ѣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011���㽭ʡ���ݸ���ѧ�����߿�ȫ��ģ��������ۣ���ѧ���� ���ͣ������
���Ǵ����к����ḻ��һ��Ԫ�أ������仯������������������������Ҫ���ã����ٵ���������ŷ��ǻ�����������Ҫ����֮һ����ش����е����仯�����������⣺
��1���ݱ������������ѧ�һ���˼����о���ֵ��N4������ӽṹ������ӵ���������ṹ���ơ���֪����1 mol N��N������167 kJ����������1 mol N��N���ų�942 kJ��������д��N4����ת��ΪN2��Ӧ���Ȼ�ѧ����ʽ��______________________��
��2���ݱ�����NH3��ֱ����������ȼ�ϵ�أ�д���õ�صĸ�����Ӧʽ��
__________________________________________________________________________��
��3����T1��ʱ����5 mol N2O5����10 L�̶��ݻ����ܱ������з������з�Ӧ��2N2O5(g) 4NO2(g)+O2(g)����H��0����Ӧ��5����ʱ�����ʵ�Ũ�Ȳ��ٷ����仯�����NO2���������Ϊ50%��
4NO2(g)+O2(g)����H��0����Ӧ��5����ʱ�����ʵ�Ũ�Ȳ��ٷ����仯�����NO2���������Ϊ50%��
������ƽ����ϵ��O2���������Ϊ__________��N2O5�����ʵ���Ϊ__________mol��
����O2��ʾ��0��5 min�ڸ÷�Ӧ��ƽ�����ʦ�(O2)= __________��
�۽�����ƽ����ϵ���¶Ƚ���T2�棬�ܱ������ڼ�С����������__________��
A��ѹǿ B���ܶ� C����Ӧ���� D��N2O5��Ũ��
��4���ں��º��ݵ��ܱ������г���NO2����������ƽ�⣺2NO2(g) N2O4(g)��ƽ��ʱN2O4��NO2�����ʵ���֮��Ϊa�������������������£��ֱ��ٳ���NO2���ٳ���N2O4��ƽ�������ı仯��ȷ����__________��
N2O4(g)��ƽ��ʱN2O4��NO2�����ʵ���֮��Ϊa�������������������£��ֱ��ٳ���NO2���ٳ���N2O4��ƽ�������ı仯��ȷ����__________��
A��������a��С B��������a����
C������NO2����a��������N2O4����a����
D������NO2����a������N2O4����a��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014���㽭ʡ������ʮУ�����������ѧ������������ѧ�Ծ��������棩 ���ͣ������
���Ǵ����к����ḻ��һ��Ԫ�أ������仯������������������������Ҫ���ã����ٵ���������ŷ��ǻ�����������Ҫ����֮һ����ش����е����仯�����������⣺
(1)�ݱ������������ѧ�һ���˼����о���ֵ��N4������ӽṹ������ӵ���������ṹ���ơ���֪����1 mol N��N������167 kJ����������1 mol N��N���ų�942 kJ��������д��N4����ת��ΪN2��Ӧ���Ȼ�ѧ����ʽ�� ��
(2)�ݱ�����NH3��ֱ����������ȼ�ϵ�أ�д���õ�صĸ�����Ӧʽ�� ��
(3)��T1��ʱ����5 mol N2O5����10L�̶��ݻ����ܱ������з������з�Ӧ��2N2O5(g) 4NO2(g)+O2(g)����H��0����Ӧ��5����ʱ�����ʵ�Ũ�Ȳ��ٷ����仯�����NO2���������Ϊ50%��
4NO2(g)+O2(g)����H��0����Ӧ��5����ʱ�����ʵ�Ũ�Ȳ��ٷ����仯�����NO2���������Ϊ50%��
����÷�Ӧ��ƽ�ⳣ��K= (���ִ���ʽ�Ӽ���)������ƽ����ϵ��O2���������Ϊ__________��
����O2��ʾ��0��5 min�ڸ÷�Ӧ��ƽ�����ʦ�(O2)= ��
�۽�����ƽ����ϵ���¶Ƚ���T2�棬�ܱ������ڼ�С���������� ��
A��ѹǿ B���ܶ� C����Ӧ���� D��N2O5��Ũ��
(4)�ں��º��ݵ��ܱ������г���NO2����������ƽ�⣺2NO2(g) N2O4(g)��ƽ��ʱN2O4��NO2�����ʵ���֮��Ϊa�������������������£��ֱ��ٳ���NO2���ٳ���N2O4��ƽ�������ı仯��ȷ����__________��
N2O4(g)��ƽ��ʱN2O4��NO2�����ʵ���֮��Ϊa�������������������£��ֱ��ٳ���NO2���ٳ���N2O4��ƽ�������ı仯��ȷ����__________��
A��������a��С B��������a���� C������NO2����a��С������N2O4����a����
D������NO2����a������N2O4����a��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ�������½�2mol SO2��2mol SO3��������һ�̶��ݻ����ܱ������У�������Ӧ��
2SO2��O2 ![]() 2SO3��ƽ��ʱSO3Ϊn mol������ͬ�¶��£��ֱ����������������
2SO3��ƽ��ʱSO3Ϊn mol������ͬ�¶��£��ֱ����������������
���з�����ʼ���ʣ�ƽ��ʱSO3�����ʵ������ܴ���n���� �� ��
A��2 mol SO2 �� 1 mol O2 B��4 mol SO2 �� 1 mol O2
C��2 mol SO2 �� 1 mol O2 �� 2 SO3 D��3 mol SO2 �� 1 SO3
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com