
已知25 ℃时有关弱酸的电离平衡常数:( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡 常数(25 ℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
则下列有关说法正确的是
A.等物质的量浓度的各溶液pH关系为pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.amol·L—1HCN溶液与amol·L—1NaOH溶液等体积混合后,所得溶液显碱性(pH>7),则c (OH-)>c(H+),c(Na+)>c(CN-)
C.冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-) +c(CO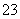 )
)
科目:高中化学 来源: 题型:
将4molA气体和2molB气体在2L的密闭容器中混合,在一定条件下发生如下反应:
2A(g)+B(g)  2C(g)若经过2秒后测得C的浓度为0.6mol/L。
2C(g)若经过2秒后测得C的浓度为0.6mol/L。
则:(1)2s内用B表示的反应速率
(2)2s时A的物质的量浓度为
(3)2s时B的物质的量为
(4)最终C的浓度 (填“能”或“不能”)达到2mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验原理或实验操作的叙述正确的是 ( )。
 [
[
A.各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘上
称量
B.欲除去NO中少量的NO2,将混合气体通入足量NaOH溶液
C.实验室用图1所示装置制取少量氨气
D.实验室用图2所示装置检验火柴头燃烧 产生的SO2
产生的SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个2L的容器中,放入2mol气体A,5分钟后,测得这种气体A还剩余0.5mol,该反应中气体A的化学反应速率是:
A.1.5mol/(L·min) B.0.15mol/(L·min)
C.0.75mol/(L·min) D.0.075mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:A.NaOH+HCl=NaCl+H2O;B.Zn+H2SO4=ZnSO4+H2↑
判断能否设计成原电池A. ,B. 。(填“能”或“不能”)
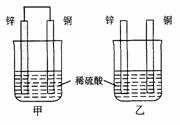 (2)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
(2)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
①下列说法正确的是____________。
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的pH均增大
②在相同时间内,两烧杯中产生气泡的速度:
甲________乙(填“>”、“<“或“=” )
③请写出图中构成原电池的负极电极反应式_________________________。
④当乙中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为_________________。
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,采用氢氧化钠溶液为电解液;则氢气应通入 极(填a或b,下同),电子从 极流出。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=206.0 kJ·mol-1
Ⅱ:CO(g)+2H2(g)=CH3OH(g) ΔH=-129.0 kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为____________________。
(2)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100 L的反应室,在一定条件下发生反应Ⅰ,测得在一定的压强下CH4的转化率与温度的关系如右图。
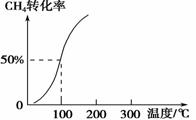 ①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为________。
①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为________。
②100 ℃时反应Ⅰ的平衡常数为________。
(3)在压强为0.1 MPa、温度为300 ℃条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,平衡后将容器的容积压缩到原来的1/2,其他条件不变,对平衡体系产生的影响是________(填字母序号)。
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.重新平衡c(H2)/c(CH3OH)减小
E.平衡常数K增大
(4) 写出甲醇-空气-KOH溶液的燃料电池负极的电极反应式:______________________。
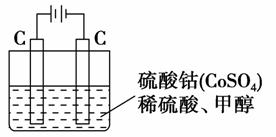 (5)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置模拟上述过程:
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置模拟上述过程:
①写出阳极电极反应式________。
②写出除去甲醇的离子方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验现象的描述正确的是
A.氢气在氯气中燃烧,发出苍白色火焰,瓶口上方有白色烟雾
B.向碳酸钠、碳酸氢钠的饱和溶液中滴加酚酞,仅前者溶液变红
C.铜在氯气中燃烧,产生棕黄色烟
D.在硫酸亚铁溶液中滴加稀K3[Fe(CN)6]后,变为特征性蓝色溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,向一体积为2 L的恒容密闭容器中充入2 mol A、1mol B,发生如下反应:2A(g)+B 3C(g) △H=—Q kJ/mol(Q>0)。经过60 s达到平衡,测得B物质的量为0.2 mol,下列对该平衡的叙述正确的是
3C(g) △H=—Q kJ/mol(Q>0)。经过60 s达到平衡,测得B物质的量为0.2 mol,下列对该平衡的叙述正确的是
A.用A浓度表示该反应速率为1.6 mol/(L•min)
B.若使容器变为1 L,则B的物质的量一定减小
C.达到平衡,测得放出热量为x kJ,则x=Q
D.若向容器再充入1 mol C,重新达到平衡,A的体积分数保持不变,则B为气态
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各指定微粒的数目比不是1∶1的是
A.Na2O2中阴离子和阳离子 B.NaOH晶体中阳离子和阴离子
C. Mg2+离子中的质子和中子 D.氯化钠中的质子总数和电子总数
Mg2+离子中的质子和中子 D.氯化钠中的质子总数和电子总数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com