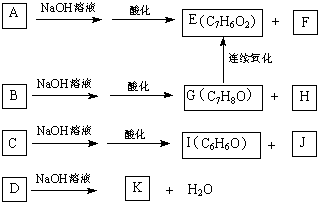
ij��ѧѧϰС��ͬѧ��ʵ������ȡ�����Ͱ����Ļ�ԭ�ԵȽ���������̽����������벢��ɶ��й�����Ľ��
���ϻ�Ϥ��
�ٰ�����CuO��Ӧ�Ļ�ѧ����ʽ��3CuO+2NH
3 3Cu+N
2+3H
2O��
��Cu
2O��ĩ�ʺ�ɫ��Cu
2O�Ǽ����������������Һ��Cu
+���ȶ�����ת��ΪCu��Cu
2+��Cu
+ Cu+Cu
2+��
���ڿ����и�������ʱ��Cu
2O�ȶ������ֽ⣬��CuO���ֽ�����Cu
2O��O
2��
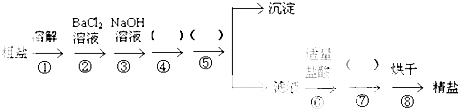
ʵ����ƣ�
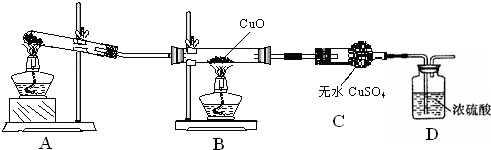
ʵ��̽����
��1��Aװ���ǰ����ķ���װ�ã���ʵ��ǰ���Թ���Ӧ�����ҩƷ��
��
��2����ͬѧ��Ϊ��ʵ�������һ����ȱ�ݣ�Aװ�ò����İ����к���ˮ������Ӱ����ʵ����ۣ�Ӧ��A��B֮������һ��װ��
����ҩƷ���ƣ��ĸ���װ�ã�
��3�����øĽ����װ�ý���ʵ�飬�ɹ۲쵽Bװ���е�����Ϊ��ɫ�����ɺ�ɫ��Cװ���е�����Ϊ
��
�������ۣ�
��4����ͬѧ��ΪNH
3��CuO��Ӧ���ɵĺ�ɫ�����п��ܺ���Cu
2O��������ͭ��������Ũ���ᡢϡ���ᡢϡ���ᡢ����������Һ��pH��ֽ����û�������Լ������������ʵ�鷽��֤����ɫ�������Ƿ���Cu
2O��Ҫѡ�õ��Լ���
��
��5����ͬѧ��Ϊ��ͨ���������պ�ɫ���壬��������Ӧǰ����������ı仯��ȷ���Ƿ���Cu
2O�����ȳƸ�������������Ϊa g����ȡ��ɫ�������������гƵ�������Ϊb g���ڿ����и��������������㶨�����Ƶ�������Ϊc g��
��ȷ�Ϻ�ɫ������ֻ����Cu���������պ�õ���������
��
��ȷ�Ϻ�ɫ�����к���Cu
2O����a��b��cӦ������ѧ��ϵΪc��
��
��չ���죺
��6����ͬѧ��Ϊ��������ʵ����ƸĽ����װ�û��ɲⶨCu�����ԭ������������ͨ���ⶨ��Ӧ��CuO��������������H
2O����������ɵģ���ʵ������ȫ��Ӧ��CuO�����ɵ�H
2O�������ֱ�Ϊm��CuO����m��H
2O������ݴ˼���Cu�����ԭ�������Ĵ���ʽΪ
��


 +
+
 +
+