
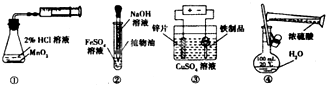
| A、装置①测定化学反应速率 |
| B、装置②制取少量的氢氧化亚铁 |
| C、装置③铁制品表面镀锌 |
| D、装置④稀释浓硫酸 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
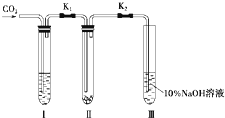 为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,某课题研究小组的同学们设计了如图的实验装置,分别进行了甲、乙两次实验:
为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,某课题研究小组的同学们设计了如图的实验装置,分别进行了甲、乙两次实验:查看答案和解析>>
科目:高中化学 来源: 题型:

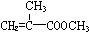 ) 合成路线的一部分.现在人们利用最新开发的+2价钯的均相钯催化剂体系,将丙炔在甲醇和一氧化碳存在下,于60℃、6MPa条件下羰基化,一步制得
) 合成路线的一部分.现在人们利用最新开发的+2价钯的均相钯催化剂体系,将丙炔在甲醇和一氧化碳存在下,于60℃、6MPa条件下羰基化,一步制得 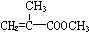 ,其化学方程式为:
,其化学方程式为: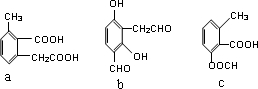 .
.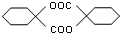 ,模仿以上流程图设计合成路线,标明每一步的反应物及反应条件.(有机物写结构简式,其它原料自选)
,模仿以上流程图设计合成路线,标明每一步的反应物及反应条件.(有机物写结构简式,其它原料自选)| 浓硫酸 |
| 170℃ |
| 高温、高压 |
| 催化剂 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、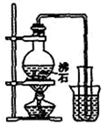 制取少量蒸馏水 |
B、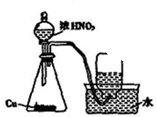 用铜和浓硝酸制取少量NO3 |
C、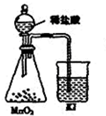 比较MnO2、Cl2、I2的氧化性 |
D、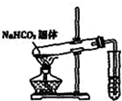 探究NaHCO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
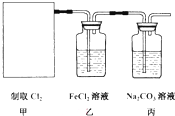
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al在氧气中燃烧时发出耀眼的白光,可用于制造信号弹 |
| B、铜的金属活动性比铝弱,可用铜罐代替铝罐储运浓硝酸 |
| C、明矾可用于除去酸性废水中的悬浮颗粒 |
| D、用高纯度的二氧化硅制作的光导纤维遇强碱会“断路” |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、电路中每转移12 mol电子,最多有 2 mol Cr2O
| ||
| B、阳极反应为Fe-2e-═Fe2+ | ||
| C、电解过程中溶液pH增大 | ||
| D、电解过程中有Fe(OH)3沉淀生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com