
| A. | 具有脱水性 | B. | 溶于水放出热量 | ||
| C. | 可用于干燥氨气 | D. | 常温下铁、铝在其中钝化 |
科目:高中化学 来源:2016-2017学年江苏省徐州市高一上第一次月考化学卷(解析版) 题型:填空题
纯碱在日常生活和化学工业中用途很广,如用于硬水软化、洗涤剂生产、食品加工、石油精炼、粗盐精制、玻璃制造等领域。工业上以食盐、氨气(主要由合成氨厂提供)和二氧化碳为主要原料生产纯碱。其流程如下:

(1)盐水精制的过程是除去溶液中各种杂质的过程.为将盐水中含有的Ca2+、Mg2+等沉淀,可以向其中加入过量纯碱.此时将混合液中不溶物除去的方法是_______,该操作中所用的仪器有铁架台(带铁圈)、烧杯等,还需要使用的仪器有___________,溶液中多余的纯碱可以加_________试剂来除去。
(2)上述工艺流程中,加压条件下通入二氧化碳进行碳酸化时没有析出碳酸钠晶体,其原因是_________。整个过程中循环利用的物质是________(用化学式表示)。
(3)若采用上述流程生产106吨纯碱,则理论上通入的二氧化碳的体积(标准状况下)不得少于_________L(不考虑二氧化碳的回收利用)。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A. | 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF | |
| B. | 若将CO2通入0.1 mol•L-1 Na2CO3溶液中至溶液呈中性,则溶液中:2c(CO32-)+c(HCO3-)=0.1 mol•L-1 | |
| C. | 向上述NaClO溶液中通HF气体至恰好完全反应时:c(Na+)>c(F-)>c(H+)>c(HClO)>c(OH-) | |
| D. | 根据上表水解方程式ClO-+H2O?HClO+OH-的平衡常数K≈10-7.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O含有的分子数为 NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA | |
| C. | 通常状况下,NA 个CO2分子占有的体积为22.4L | |
| D. | 物质的量为0.5 mol的MgCl2中,含有Mg2+个数为 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磁性氧化铁溶于稀硝酸:Fe3O4+8H++NO3-═3Fe3++NO↑+4H2O | |
| B. | Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| C. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 5 | C. | 8 | D. | 12 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上第一次月考化学试卷(解析版) 题型:选择题
在密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)  2C(g) ΔH<0。达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )
2C(g) ΔH<0。达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )
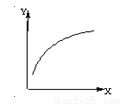
X | Y | |
A | 再加入A | B的转化率 |
B | 再加入C | A的体积分数 |
C | 减小压强 | A的转化率 |
D | 升高温度 | 混合气体平均摩尔质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com