
| A. | “光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关 | |
| B. | Al(OH)3可作阻燃剂,因此可以用于灭火 | |
| C. | SiO2可用于制造光导纤维,其性质稳定,不溶于强酸、强碱 | |
| D. | 焰火的五彩缤纷是某些金属元素的性质的展现 |
分析 A.氮的氧化物可导致酸雨及光化学烟雾发生;
B.Al(OH)3分解生成的高熔点的氧化铝;
C.二氧化硅对光具有良好的全反射作用,与强碱反应;
D.某些金属灼烧具有特殊的焰色.
解答 解:A.氮的氧化物可导致酸雨及光化学烟雾发生,“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关,故A正确;
B.Al(OH)3分解生成的高熔点的氧化铝,且均不燃烧,分解吸收热量,可降低温度,则Al(OH)3可作阻燃剂,因此可以用于灭火,故B正确;
C.二氧化硅对光具有良好的全反射作用,用于制造光导纤维,但与强碱反应,故C错误;
D.某些金属灼烧具有特殊的焰色,则焰火的五彩缤纷是某些金属元素的性质的展现,故D正确;
故选C.
点评 本题考查物质的性质及应用,为高频考点,把握环境污染及保护、性质与用途为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
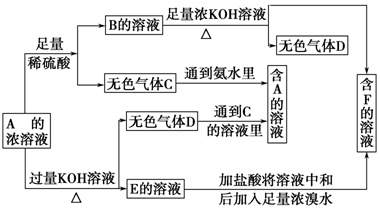
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g氮气所含有的原子数目为NA | |
| B. | 16g O2中所含的氧原子数为NA | |
| C. | 标准状况下,22.4L水中含有NA个水分子 | |
| D. | 标准状况下,22.4L氯化氢所含的原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 氧化物 | 环境问题 | 主要来源 | |
| A | CO2 | 酸雨 | 化石燃料的燃烧 |
| B | CO | CO中毒 | 汽车尾气和化石燃料的不完全燃烧 |
| C | NO2 | 温室效应 | 工厂废气的排放 |
| D | SO2 | 光化学烟雾 | 汽车尾气的排放 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X 中一定不存在Fe3O4 | B. | Y 中不一定存在MnO2 | ||
| C. | Z 溶液中一定含有Na2SO4 | D. | 不溶物Y 中一定含有Fe和CuO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c=$\frac{b}{11.2V}$ | B. | p=m+$\frac{{V}_{c}}{125}$ | C. | n=m+17Vc | D. | $\frac{17}{9}$m<p<$\frac{5}{3}$m |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃、101.3kPa时,11.2L H2中含有的原子数为NA | |
| B. | 39g Na2O2与足量水充分反应时转移的电子数为0.5NA | |
| C. | 17 g羟基与17 g氨气所含电子数均为10NA | |
| D. | 1mol/L Na2SO4溶液中离子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com