
【题目】某温度下,浓度都是1mol·L-1的两种气体X2和Y2在密闭容器中反应,经过tmin后,测得物质的浓度分别为:c(X2)=0.4mol·L-1,c(Y2)=0.8mol·L-1,则该反应的方程式可表示为()
A. X2+2Y2![]() 2XY2B. 2X2+Y2
2XY2B. 2X2+Y2![]() 2X2Y
2X2Y
C. X2+3Y2![]() 2XY3D. 3X2+Y2
2XY3D. 3X2+Y2![]() 2X3Y
2X3Y
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、M、W在元素周期表中的相对位置如图,其中Z的核电荷数是Y 的两倍.下列说法正确的是
![]()
A. M位于元素周期表中第三周期ⅣA族
B. 原子半径:Z>M>X
C. 气态氢化物的热稳定性:Y>X>W
D. W的氧化物既能与NaOH反应,也能与HF反应,属于两性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH![]() H++CH3COO-,下列叙述正确的是( )
H++CH3COO-,下列叙述正确的是( )
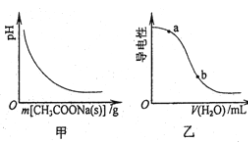
A.图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
B.图乙表示向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b
C.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
D.0.10mol·L-1的CH3COOH溶液中加水稀释,溶液中c(OH-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZrO2常用作陶瓷材料,可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2,还含少量Fe2O3、Al2O3、SiO2等杂质)通过如下方法制取:

已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表。
金属离子 | Fe3+ | Al3+ | ZrO2+ |
开始沉淀时pH | 1.9 | 3.3 | 6.2 |
沉淀完全时pH | 3.2 | 5.2 | 8.0 |
(1)熔融时ZrSiO4发生反应的化学方程式为 ,滤渣I的化学式为 。
(2)为使滤液I的杂质离子沉淀完全,需用氨水调pH=a,则a的范围是 ;继续加氨水至pH=b时,所发生反应的离子方程式为 。
(3)向过滤III所得滤液中加入CaCO3粉末并加热,得到两种气体。该反应的离子方程式为 。
(4)为得到纯净的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检查)。

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)验证氯气的氧化性强于碘的实验现象是_____________________________________。
(2)B中溶液发生反应的离子方程式是_________________________________________。
(3)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是___________________。
(4)过程Ⅲ实验的目的是___________________________________________________。
(5)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下____________________,得电子能力逐渐减弱。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常以铬铁矿(主要成分为亚铬酸亚铁FeCr2O4,还有Al2O3、SiO2等杂质)为主要原料生产红矾钠(Na2Cr2O7),某实验小组模拟其流程如下图所示:
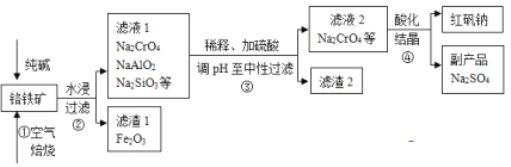
(1)步骤①中,焙烧时所用的仪器材质应选用_________(填“瓷质”、“铁质”或“石英质”),选用该材质的原因是(结合化学方程式解释): _____________________________________________。
(2)配平步骤①中主要反应:
____FeCr2O4+___O2+___Na2CO3![]() ___Fe2O3+___Na2CrO4+___CO2 _____________
___Fe2O3+___Na2CrO4+___CO2 _____________
(3)操作④中,酸化时,CrO42- (黄色)转化为Cr2O72-(橙色),写出平衡转化的离子方程式:____________________________________________________________。用红矾钠溶液进行下列实验:
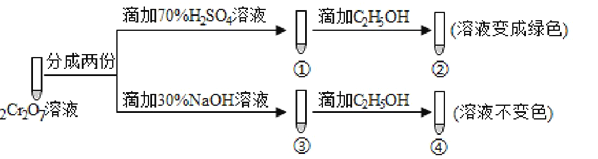
实验过程中,①中溶液橙色加深,③中溶液变黄,对比②和④可得出结论:___________________。
(4)步骤③用硫酸将溶液的pH调至中性,所得滤渣的主要成分是__________、____________;
(5)下图是Na2Cr2O7·2H2O和Na2SO4的溶解度曲线,步骤④中获得固态副产品Na2SO4的实验操作方法为____________、___________。

(6)某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴阳极,槽中盛放含铬废水,原理示意图如上,若不考虑气体的溶解,当收集到H213.44L(标准状况下)时有 ____________mol Cr2O72-被还原,一段时间后产生Fe(OH)3和Cr(OH)3沉淀。若电解后溶液中c(Cr3+)=3.0×10-5mol·L-1,则c(Fe3+)=_________。(已知Ksp[Fe(OH)3]=4.0×10-38mol·L-1,Ksp[Cr(OH)3]=6.0×10-31mol·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能够证明甲烷构型是正四面体的事实是( )
A.甲烷的四个键键能相同
B.甲烷的四个键键长相等
C.甲烷的所有C—H键键角相等
D.二氯甲烷没有同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氢为原料的工业生产工艺及氢的获得是科技工作者研究的重要课题。
(1)工业生产中可利用H2还原CO2制备清洁能源甲醇。
①已知CO(g)和H2(g)的燃烧热(△H)分别为-283.0kJ·mol-1、-285.8kJ·mol-1。由H2和CO生成甲醇的热化学方程式为:2H2(g)+CO(g)= CH3OH(1)的△H=-91kJ·mol-1。则3H2(g)+CO2(g)=CH3OH(1)+H2O(1)的△H=____________kJ·mol-1。
②将一定量的CO2和H2充入到某恒容密闭容器中,测得在不同催化剂作用下,相同时间内CO2的转化率如图甲所示。

该反应在a点达到平衡状态,a点转化率比b点的高,其原因是____________。
(2)利用CO和H2O生产H2:CO(g)+H2O(g) CO2(g)+H2(g)。将不同配比的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中。有关数据如下表:
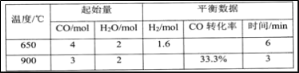
①该反应的正反应为________反应(填“吸热”、“放热”)。
②650℃时,下列叙述说明达到化学平衡状态的是_____(填标号)
a.v(CO):v(H2O):v(H2):v(CO2)=1:1:1:1
b.生成n mol CO2(g)的同时生成n mol H2O(g)
c.n mol CO断裂的同时断裂2n mol H—H
d.某时刻,n(CO):n(H2O):n(CO2):n(H2)=6:1:4:4
③900℃时,达平衡时v(H2O)=_______mol·L-1·min-1。(结果保留两位有效数字)
(3)利用工业废气中的H2S热分解制H2:2H2S(g) 2H2(g)+S2(g)。现将0.2molH2S(g)通入某恒压密闭容器中,起始压强p0=aMPa,在不同温度下测得H2S的平衡转化率如图乙所示,则T6℃时,该反应的Kp=________(用含a的代数式表示)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com