
| A. | IBr可能是一种有色物质 | |
| B. | 在许多反应中IBr是强氧化剂 | |
| C. | 在IBr与水的反应中,IBr既是氧化剂又是还原剂 | |
| D. | 与NaOH溶液反应有NaIO生成 |
分析 IBr+H2O=HBr+HIO中,IBr中I元素化合价为+1价,具有氧化性,与水发生反应元素的化合价没有发生变化,为水解反应,以此解答该题.
解答 解:A.溴化碘(IBr)的化学性质与卤素单质相似,则IBr是一种有色物质,故A正确;
B.IBr中I元素化合价为+1价,具有氧化性,则在许多反应中IBr是强氧化剂,故B正确;
C.与水的反应中,没有元素的化合价变化,则不属于氧化还原反应,故C错误;
D.IBr+H2O=HBr+HIO,则IBr与NaOH溶液反应生成的产物中有NaIO和NaBr,故D正确.
故选C.
点评 本题以卤族互化物的性质考查氧化还原反应,为高考常见题型,注意从氧化化合价的角度认识氧化还原反应的相关概念和相关物质的性质,答题时注意题给信息,为解答该题的关键.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | ⑤ |
| 甲烷 | 乙烯 | 戊烷 | 2-甲基戊烷 | 辛烷 |
| A. | ②③之间 | B. | ③④之间 | C. | ⑤之后 | D. | ④⑤之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ Cu2+ NO3- Cl- | B. | K+ NO3- Na+ Cl- | ||
| C. | K+ CO32- NO3- Ca2+ | D. | K+ NO3- SO42- Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
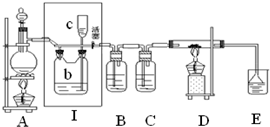 如图所示,是一个制取氯气并以氯气为原料进行特定反应的装置,其中各试剂瓶装的试剂为:B(碘化钾淀粉溶液),C(水),E(NaOH溶液).
如图所示,是一个制取氯气并以氯气为原料进行特定反应的装置,其中各试剂瓶装的试剂为:B(碘化钾淀粉溶液),C(水),E(NaOH溶液).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 53 | B. | 78 | C. | 131 | D. | 125 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应放出热量的多少与反应物的质量和状态有关 | |
| B. | 若某反应正向进行时为放热反应,则该反应逆向进行时必为吸热反应 | |
| C. | 吸热反应的发生都需要加热,吸热反应都没有利用价值 | |
| D. | 不管是吸热反应还是放热反应,升高温度,反应速率均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 室温下,HA-的电离常数Ka2=1.0×10-7 | |
| B. | 室温下,0.1mol/L的NaHA溶液显酸性 | |
| C. | 室温下,0.2mol/L的H2A与0.1mol/L的NaOH溶液等体积混合,溶液pH=1.8 | |
| D. | 0.1mol/L的Na2A溶液中c(OH-)=c(H+)+c(HA-)+2c(H2A) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com