
下列各个曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中: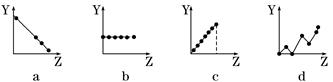
(1)ⅡA族元素的最外层电子数________;
(2)第3周期元素的最高化合价________;
(3)F-、Na+、Mg2+、Al3+的离子半径________。
科目:高中化学 来源: 题型:单选题
超铀元素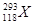 的发现是世界重大科技成果之一,它有力地支持了“稳定岛”(具有“魔数”数目的质子和中子的原子核的化学元素特别稳定)的假说,原子
的发现是世界重大科技成果之一,它有力地支持了“稳定岛”(具有“魔数”数目的质子和中子的原子核的化学元素特别稳定)的假说,原子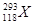 的中子数与核外电子数之差为
的中子数与核外电子数之差为
| A.0 | B.118 |
| C.57 | D.175 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)下面是元素周期表的一部分。据A至H在周期表中位置,请回答下列问题:
| A | | | |||||||||||||||
| | | | | | E | | G | | |||||||||
| B | C | D | | | F | H | | ||||||||||
| | | | | | | | | | | | | | | | | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)(1) 把除去氧化膜的铁丝投入到盛有稀硫酸的试管中,产生氢气 的速率变化情况如图所示图中t1~t2速率变化的主要原因是 ,t2~t3速率变化的主要原因是 。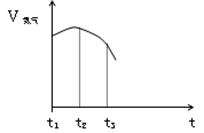
(2)甲、乙、丙、丁是四种短周期元素,乙原子中K层与M层电子数相等;甲原子的核 外电子数比乙原子核外电子数少1;丙原子的最外层电子数是次外层电子数的2倍;丁原子核电荷数比丙原子核电荷数多2。请回答:
①甲的单质与水反应的离子方程式为 ;②乙元素在周期表中的位置为 ;③丙元素的最高价氧化物的电子式为 ;④甲与丁两种元素可组成的具有强氧化性的物质是 。(填化学式)
(3)某元素R,它的最高价含氧酸的阴离子是RO4ˉ,则其气态氢化物的化学式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)现有A、B、C、D、E、F、G、H八种短周期主族元素,原子序数依次增大。已知A与E、D与G分别同主族;E、F、G、H同周期;A分别与C、D可形成含有10个电子的共价化合物M、N;B的最外层电子数是其电子层数的2倍;D是地壳中含量最多的元素;F位于B的前一主族。请回答下列问题:
(1)元素B在周期表中的位置 ,M的空间构型是 。
(2)A、D、E三种元素组成一种常见化合物,W与该化合物的阴离子具有相同的原子种类和数目且不带电,W的电子式为 ,工业上利用某一个反应可同时生产该化合物和H的单质,写出该反应的化学方程式 。
(3)E、F元素的最高价氧化物对应的水化物之间反应的离子方程式 。
(4)M、N均能结合H+,其中结合H+能力较强的是 (填化学式)。N结合H+所形成的微粒中心原子采用 杂化。其键角比N中的键角大,原因为 。
(5)E分别与D、G形成摩尔质量相等的化合物X、Y,其中Y的水溶液显碱性的原因是
(用离子方程式表示)。常温下7.8 g X与水反应放出Q kJ热量(Q>0),写出该反应的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(11分)A、B、C、D四种短周期元素。原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体甲;D的L层电子数等于K、M两个电子层上的电子数之和。
(1)写出下列元素的名称:A_______,B ,C_______,D 。
(2)D的质子数和中子数相等,D的原子组成符号为 ,它的最高价为___________价。
(3)用电子式表示A、D两元素形成AD2的过程: ;
写出C2B2的电子式 。
(4)氢元素与B、D 均可以形成原子个数比为2:1的化合物,H2B的熔沸点高于H2D的原因是
。
(5)写出甲和A的最高价氧化物反应的化学方式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)A、B、C、D、E、F为原子序数依次增大的六种元素。已知:A是周期表中原子半径最小的元素,B的基态原子核外电子有7种运动状态,B、C、E三种元素原子中未成对电子数之比为3:2:l,D原子核外有4个能级且均充满电子,D与E可形成DE2型化合物,F原子核外最外层只有1个电子,其余各层均充满电子。回答下列问题:
(1)写出下列元素的名称:B______ C_____ E_______
(2)F在元素周朔表的位置是_________,与F同周期且未成对电子数最多的元素为______(填写元素符号),该元素基态原子的核外电子电子排布式为__________;
(3)B与D组成的化合物可以与水反应,写出它与水反应的化学方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①~⑨九种元素在周期表中的位置。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | ⑤ | | ⑥ | | |
| 3 | ① | ③ | ④ | | | | ⑦ | ⑨ |
| 4 | ② | | | | | | ⑧ | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
[化学—选修3物质结构与性质](15分)
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于周期表的_________区;溴的价电子排布式为____________________。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________。
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是_________。
| | 氟 | 氯 | 溴 | 碘 | 铍 |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、 “<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、 “<”或“=”)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com