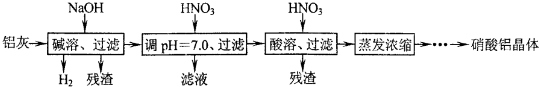
�������㷺�����л��ϳɡ�ӡȾ��ҵ�ȣ���ҵ��������Ϊԭ�ϣ���Ҫ�ɷ�ΪAl��������Al
2O
3��Fe
2O
3��SiO
2��CaO��MgO�ȣ��Ʊ��������Ĺ����������£�

��֪��Al��OH��
3�������ܽ��pH���±���
| Al��OH��3 | ��ʼ���� | ������ȫ | ������ʼ�ܽ� | ������ȫ�ܽ� |
| pH | 3.3 | 5.0 | 7.8 | 12.8 |
�ش��������⣺
��1������ʱ����������Ӧ�����ӷ���ʽΪ______��
��2�����������е�һ�μ��������pH=7.0��Ŀ����______��pH=7.0ʱ����Һ��c��Al
3+��=______��ͨ�������£�Ksp[Al��OH��
3]=1.3×10
-33����
��3�����������ʸ��ᡢ��ķ�Ӧ�����ڼ��ܡ���pH=7.0�����ܹ����У����������ļ������ʵ���֮��n
1��NaOH����n
2��HNO
3����n
3��HNO
3��=______��
��4������1t����������������[Al��NO
3��
3?9H
2O]�����������7.5t���������壮��������������Ԫ�ص���ʧ��Ϊ10%��������������Ԫ�ص�����������


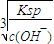 ��
��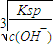 =
=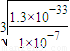 =1.3×10-12mol/L��
=1.3×10-12mol/L��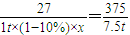 ��
��

 �����Ļ�������ҵϵ�д�
�����Ļ�������ҵϵ�д�
 ��������ͭ�ĵ��ʡ��Ͻ��仯���������������е�Ӧ�������㷺��
��������ͭ�ĵ��ʡ��Ͻ��仯���������������е�Ӧ�������㷺�� ���ǵؿ��к�����ߵĽ���Ԫ�أ��䵥�ʡ��Ͻ��仯���������������е�Ӧ�������㷺�������������������仯�������Ҫԭ�ϣ�
���ǵؿ��к�����ߵĽ���Ԫ�أ��䵥�ʡ��Ͻ��仯���������������е�Ӧ�������㷺�������������������仯�������Ҫԭ�ϣ�
