

 N2+2OH-+4H2O 0.001 ③加酸,升高温度,加水
N2+2OH-+4H2O 0.001 ③加酸,升高温度,加水 N2+2OH-+4H2O。③水解的离子方程式为NO2-+H2O
N2+2OH-+4H2O。③水解的离子方程式为NO2-+H2O HNO2+OH-,据“越热越水解、越稀越水解”,可知加热或加水稀释能促进水解;另外,降低生成物浓度,也可促进水解。
HNO2+OH-,据“越热越水解、越稀越水解”,可知加热或加水稀释能促进水解;另外,降低生成物浓度,也可促进水解。

科目:高中化学 来源:不详 题型:单选题
| A.氧化产物为Cl2 |
| B.参加反应的氧化剂与还原剂的物质的量之比为1∶2 |
| C.若有3 mol H2O生成,则反应中有2 mol电子转移 |
| D.当该反应生成2.24 L Cl2(标准状况)时,反应中有0.1 mol电子转移 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.34 mol | B.0.38 mol |
| C.0.28 mol | D.0.2 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
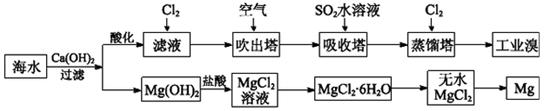
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.224L | B.0.448L | C.0.672L | D.0.896L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 6Cu+SO2↑反应中,说法正确的是( )
6Cu+SO2↑反应中,说法正确的是( )| A.Cu2O在反应中被氧化 |
| B.Cu2S在反应中既是氧化剂又是还原剂 |
| C.Cu既是氧化产物又是还原产物 |
| D.若反应中转移12 mol电子,则生成6 mol Cu |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | X | Y | Z |
| W | | | |

 。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
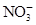 、Fe3+、
、Fe3+、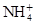 、H2O和H+六种粒子,分别属于同一氧化还原反应中的反应物和生成物,下列叙述错误的是( )
、H2O和H+六种粒子,分别属于同一氧化还原反应中的反应物和生成物,下列叙述错误的是( )| A.氧化剂与还原剂的物质的量之比为8∶1 |
B.还原产物为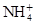 |
C.若有1 mol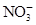 参加还原反应,转移8 mol e- 参加还原反应,转移8 mol e- |
| D.若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com