
 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:解答题
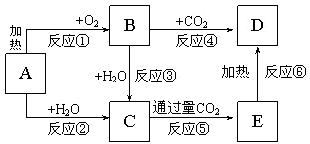 如图所示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色.
如图所示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.8molCO2 | B. | 标准状况下22.4LO2 | ||
| C. | 3.6g水 | D. | 含NA个NH3分子的氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | 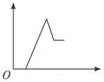 | C. | 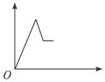 | D. | 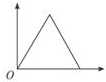 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  稀HNO3滴入Na2SO3溶液中 | B. |  SO2气体通入新制氯水中 | ||
| C. |  NaOH溶液滴入Ba(HCO3)2溶液中 | D. | 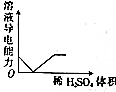 稀H2SO4滴入Ba(OH)2溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol•L-1的NaHSO3溶液与1.0mol•L-1的NaClO溶液等体积混合:HSO3-+ClO-═SO42-+Cl-+H+ | |
| B. | 向Ca(HCO3)2溶液中加入足量的澄清石灰水:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| C. | 氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O | |
| D. | H218O中投入Na2O2固体:2H218O+2Na2O2═4OH-+4Na++18O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
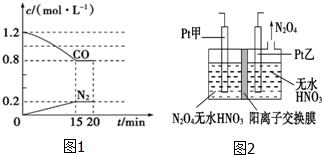 “霾”是当今世界环境热点话题.目前我国许多地方空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
“霾”是当今世界环境热点话题.目前我国许多地方空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
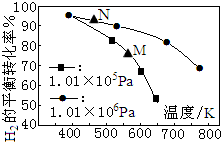 已知反应:CO(g)+3H2(g)?CH4(g)+H2O(g).起始以物质的量之比为1:1充入反应物,不同压强条件下,H2的平衡转化率随温度的变化情况如图所示(M、N点标记为▲).下列有关说法正确的是( )
已知反应:CO(g)+3H2(g)?CH4(g)+H2O(g).起始以物质的量之比为1:1充入反应物,不同压强条件下,H2的平衡转化率随温度的变化情况如图所示(M、N点标记为▲).下列有关说法正确的是( )| A. | 上述反应的△H<0 | |
| B. | N点时的反应速率一定比M点快 | |
| C. | 降低温度,H2的转化率可达到100% | |
| D. | 工业用此法制取甲烷应采用更高的压强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com