
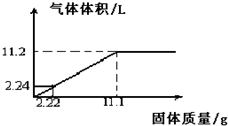
分析 (1)加入Mg、Al混合物11.1g时,硫酸完全反应,根据氢气的体积计算硫酸的物质的量,进而计算硫酸的物质的量浓度;
(2)100mL硫酸完全反应需要混合物质量11.1g,生成氢气为11.2L,故350mL硫酸完全反应需要混合物的质量=11.1g×$\frac{350mL}{100mL}$=38.85g>33.3g,故硫酸有剩余,根据混合物的质量计算生成氢气的体积;
(3)令11.1g混合物中Mg、Al的物质的量分别为x mol、y mol,根据二者质量及电子转移守恒列方程计算.
解答 解:(1)加入Mg、Al混合物11.1g时,硫酸完全反应,生成氢气11.2L,氢气的物质的量=$\frac{11.2L}{22.4L/mol}$=0.5mol,由H2SO4~H2可知n(H2SO4)=n(H2)=0.5mol,故c(H2SO4)=$\frac{0.5mol}{0.1L}$=5mol/L;
故答案为:5;
(2)100mL硫酸完全反应需要混合物质量11.1g,生成氢气为11.2L,故350mL硫酸完全反应需要混合物的质量=11.1g×$\frac{350mL}{100mL}$=38.85g>33.3g,故硫酸有剩余,33.3g混合物完全反应,故生成氢气的体积=11.2L×$\frac{33.3g}{11.1g}$=33.6L,
故答案为:33.6;
(3)令11.1g混合物中Mg、Al的物质的量分别为x mol、y mol,根据二者质量及电子转移守恒列方程,则:$\left\{\begin{array}{l}{24x+27y=11.1}\\{2x+3y=0.5×2}\end{array}\right.$
解得x=0.35、y=0.1,
故原固体混合物中Mg和Al的物质的量之比为0.35mol:0.1mol=7:2
故答案为:7:2.
点评 本题考查混合物计算、化学反应图象有关计算,侧重考查学生获取信息的能力、分析解决问题的能力,注意守恒思想运用,难度中等.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:多选题
| A. | NaCl、NaOH、NH4NO3、CaCO3 | B. | FeCl3、CuSO4、Mg(OH)2、NaCl | ||
| C. | BaSO4、AgCl、KOH、NH4Cl | D. | NH4HCO3、MgCl2、BaCl2、Ba(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与盐酸溶液反应 | B. | 澄清石灰水和HNO3溶液反应 | ||
| C. | KOH溶液和醋酸溶液反应 | D. | Ba(OH)2和H2SO4溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸分子中含有羧基,可与Na2CO3溶液反应生成CO2 | |
| B. | 淀粉和纤维素都属于高分子化合物 | |
| C. | 苯不能使酸性高锰酸钾褪色 | |
| D. | 苯分子中不存在碳碳双键所以不能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  图表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 | |
| B. |  图表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| C. |  图表示0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1醋酸溶液得到的滴定曲线 | |
| D. |  图是亚硫酸氢钠粉末投入稀硝酸溶液中有关图象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO K=4.5×10-4
氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO K=4.5×10-4查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2H2(g)+O2(g)=2H2O(l)△H=-483.6 kJ•mol-1,则氢气的燃烧热为483.6 kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 已知2C(s)+2O2(g)=2CO2(g)△H1 2C(s)+O2(g)=2CO(g)△H2 则△H1<△H2 | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com