
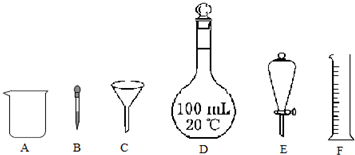
分析 (1)仪器E为分液漏斗,可分离互不相溶、分层的液体;
(2)结合m=nM、n=cV计算,需要100mL容量瓶、烧杯、玻璃棒、胶头滴管等.
解答 解:(1)仪器E为分液漏斗,可分离互不相溶、分层的液体,
a.水和四氯化碳分层,可利用分液漏斗分离,故选;
b.水和酒精互溶,应选蒸馏法,故不选;
c.水中的泥沙不溶于水,应选过滤法,故不选;
故答案为:a;
(2)配制100mL 0.1mol•L-1NaOH溶液,所需氢氧化钠固体的质量是0.1L×0.1mol/L×40g/mol=0.4g,实验中用到的上述仪器有ABD(或ABDF),还缺少的玻璃仪器是玻璃棒,故答案为:0.4;ABD(或ABDF);玻璃棒.
点评 本题考查混合物分离提纯及溶液配制,为高频考点,把握仪器的使用、混合物分离提纯方法、溶液配制实验为解答的关键,侧重分析与实验能力的考查,注意仪器的使用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 每个分子中都含有氮分子 | B. | 每个分子中的氮原子个数相等 | ||
| C. | 每种物质中氮元素的质量分数相同 | D. | 都属于氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和氯水中 Cl-、NO3-、Na+、SO32- | |
| B. | pH=12的溶液中 NO3-、I-、Na+ | |
| C. | NaHS溶液中 SO42-、K+、Cl-、Al3+ | |
| D. | 使甲基橙变红的溶液中 C6H5O-、K+、SO42-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
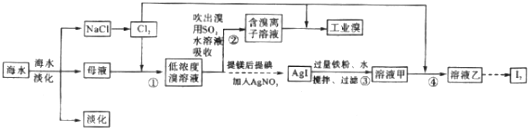
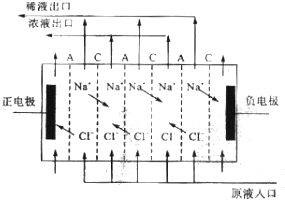
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na.Mg、Al还原性依次减弱 | B. | I2、Br2、Cl2氧化性依次增强 | ||
| C. | 原子半径:F<Mg<K | D. | 稳定性:PH3>H2S>HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “绿色化学”的理念是从源头上减少和消除工业产生对环境的污染 | |
| B. | 氢能是清洁能源,工业上电解水法制大量氢气符合节能减排理念 | |
| C. | 如将纳米材料分散到液体分散剂中,该分散系可发生丁达尔现象,由此可推测纳米材料的直径为1~100nm之间 | |
| D. | 将苦卤浓缩、氧化,鼓入热空气或水蒸气提取海水中的溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 含有0.6mol Ca2+ | B. | 含有0.3mol Cl- | ||
| C. | n(Na+):n(OH-)=1:5 | D. | 所含元素中钙元素的质量很大 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com