
【题目】![]() 是阿伏伽德罗常数的值,下列说法正确的是( )
是阿伏伽德罗常数的值,下列说法正确的是( )
A.23 g Na在氧气中充分燃烧生成![]() ,转移电子数为2
,转移电子数为2![]()
B.![]() 的NaOH溶液中,含有
的NaOH溶液中,含有![]() 的数日为0.01
的数日为0.01![]()
C.电子数为![]() 的
的![]() 分子的质量为1.6g
分子的质量为1.6g
D.标准状况下,3.36 L的![]() 中含有氧原子的数目为0.45
中含有氧原子的数目为0.45![]()
 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】T℃时,在2L的密闭容器中,气体X、Y、Z的物质的量随时间的变化曲线如图所示。

(1)该反应的化学方程式为_________________________.
(2)0~10s内,X的化学反应速率为___________________.
(3)该反应在不同温度下的平衡常数如表所示:
T/℃ | 100 | 220 | 830 | 1000 | 1200 |
K | 45.00 | 32.00 | 1.00 | 0.60 | 0.38 |
则该反应的ΔH__________0 (填“>”、“<”或“=”)
(4)830℃时,在容积为10L的恒容密闭容器中充入5molX气体、7.8molY气体和7.1mol Z气体,此时υ(正)_______υ(逆) (填“>”、“<”或“=”)
(5)上图所示反应的温度为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莫尔盐的化学式为![]() (相对分子质量为392),能溶于水,不溶于乙醇,是一种重要的还原剂,在空气中比一般的亚铁盐稳定。下面是某学习小组设计制备少量莫尔盐的实验装置及步骤。回答相关问题:
(相对分子质量为392),能溶于水,不溶于乙醇,是一种重要的还原剂,在空气中比一般的亚铁盐稳定。下面是某学习小组设计制备少量莫尔盐的实验装置及步骤。回答相关问题:

步骤一:制取莫尔盐
(1)连接装置,检查装置气密性后加入药品。在锥形瓶中加入![]() 铁屑和少量的碳粉,在三颈烧瓶中加入
铁屑和少量的碳粉,在三颈烧瓶中加入![]() 晶体.加入少量碳粉的作用是_____。
晶体.加入少量碳粉的作用是_____。
(2)向分液漏斗中注入![]() 稀硫酸后,关闭活塞
稀硫酸后,关闭活塞![]() ,打开
,打开![]() 、
、![]() ,待稀硫酸注入锥形瓶后关闭
,待稀硫酸注入锥形瓶后关闭![]() 。
。![]() 装置中反应的离子方程式为______。
装置中反应的离子方程式为______。
(3)待大部分铁粉溶解后,打开![]() 、关闭
、关闭![]() ,此时可以看到的现象为_____,原因是_____。
,此时可以看到的现象为_____,原因是_____。
(4)关闭活塞![]() 、
、![]() ,采用100℃水浴蒸发
,采用100℃水浴蒸发![]() 中水分,液面产生晶膜时,停止加热,冷却结晶、____(填操作名称)、用无水乙醇洗涤晶体。该反应中硫酸需过量,保持溶液的
中水分,液面产生晶膜时,停止加热,冷却结晶、____(填操作名称)、用无水乙醇洗涤晶体。该反应中硫酸需过量,保持溶液的![]() 在1~2之间,其目的为_____。
在1~2之间,其目的为_____。
(5)装置![]() 的作用为______。
的作用为______。
步骤二:测定莫尔盐样品的纯度
(6)称取所得莫尔盐样品![]() ,用煮沸后冷却的蒸馏水配成
,用煮沸后冷却的蒸馏水配成![]() 溶液,取
溶液,取![]() 溶液加入稀硫酸,用
溶液加入稀硫酸,用![]() 的
的![]() 溶液滴定,达到滴定终点时消耗
溶液滴定,达到滴定终点时消耗![]() 溶液.滴定反应的离子方程式为________,该样品的纯度为________。
溶液.滴定反应的离子方程式为________,该样品的纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气体A,B分别为0.6mol和0.5mol,在0.4L密闭容器中发生反应:3A+B![]() aC+2D,经5min后,此时气体C为0.2mol;又知在此反应时间内,D的平均反应速率为0.1mol/(L·min),下面的结论正确的是( )
aC+2D,经5min后,此时气体C为0.2mol;又知在此反应时间内,D的平均反应速率为0.1mol/(L·min),下面的结论正确的是( )
A.此时,反应混合物总物质的量为1molB.B的转化率40%
C.A的平均反应速率为0.1mol/(L·min)D.a值为2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为______________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
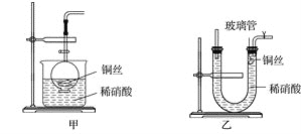
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填序号)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是__________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是______________________________________________________。
②让反应停止的操作方法及原因是__________________________________________。
(4)以下收集NO气体的装置,合理的是________(填序号)。

(5)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
①NO的体积为________ L,NO2的体积为________ L。
②待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为___。利用反应6NO2+8NH3![]() 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是___L。
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是___L。
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=﹣196.6kJ·mol-1
2SO3(g) ΔH1=﹣196.6kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH2=﹣113.0kJ·mol-1
2NO2(g) ΔH2=﹣113.0kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH=___kJ·mol-1。
SO3(g)+NO(g)的ΔH=___kJ·mol-1。
(3)一定条件下,将2molNO2与2molSO2置于容积固定的恒温密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___(填字母)
a.混合气体密度保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1molSO3的同时生成1molNO2
该反应达平衡状态后,若再向该容器充入1molNO2与1molSO2,则SO2的转化率将___(填“增大”“减小”或“不变”)
(4)已知N2O4(g)![]() 2NO2(g) ΔH>0,现将1molN2O4充入一恒压密闭容器中,下列示意图不能说明反应达到平衡状态的是___。
2NO2(g) ΔH>0,现将1molN2O4充入一恒压密闭容器中,下列示意图不能说明反应达到平衡状态的是___。
A. B.
B. C.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,纯水中存在的平衡:H2O ![]() H+ + OH-,下列叙述正确的是
H+ + OH-,下列叙述正确的是
A. 将水加热,Kw增大,pH不变
B. 加入稀盐酸,平衡逆向移动,c(H+)降低
C. 加入氢氧化钠溶液,平衡逆向移动,Kw变小
D. 加入少量固体CH3COONa,平衡正向移动,c(H+)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸工业尾气中的氮氧化合物NOx(NO、NO2、N2O4)常用的处理方法有以下两种:
①碱液(Na2CO3或NaOH溶液)吸收法。用Na2CO3溶液吸收反应原理如下:
NO + NO2 + Na2CO3 == 2NaNO2 + CO2;2NO2 + Na2CO3 == NaNO2 + NaNO3 + CO2
②氨的催化氧化法,反应原理是:NOx + NH3![]() N2 + H2O
N2 + H2O
现将标准状况下2.016 L氮氧化合物NOx 通入50 mL 1.0 mol·L-1的Na2CO3溶液,恰好反应完全,且测得反应后溶液中n(NO2-)∶n(NO3-) = 4∶1,下列说法正确的是
A. 混合气体中V(N2O4) = 0.336 L
B. 混合气体中n(NO)∶n(NO2) = 1∶5
C. NOx能够完全被Na2CO3溶液吸收,则x ≤ 1.5
D. 如采用氨的催化氧化法处理,理论消耗n(NH3) = ![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳氧化物、氮氧化物、硫氧化物等大气污染物的处理,对缓解环境污染、能源危机具有重要意义。
(1)已知CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH1=-41.2kJ·mol-1
CO2(g)+H2(g) ΔH1=-41.2kJ·mol-1
CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH2=+247.3kJ·mol-1
2CO(g)+2H2(g) ΔH2=+247.3kJ·mol-1
CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) ΔH3=-1160.0kJ·mol-1
2N2(g)+CO2(g)+2H2O(g) ΔH3=-1160.0kJ·mol-1
则2NO(g)+2CO(g)![]() N2(g)+2CO2(g),ΔH=___ kJ·mol-1。
N2(g)+2CO2(g),ΔH=___ kJ·mol-1。
(2)氮氧化物和硫氧化物在一定条件下会发生反应,NO2(g)+SO2(g)![]() SO3(g)+NO(g) ΔH<0,从而实现物质转换降低能耗。某化学小组对该反应进行相关实验探究:在固定体积的密闭容器中,使用某种催化剂,改变原料气配比进行多组实验(各次实验的温度可能相同,也可能不同),测得NO2的平衡转化率如图所示:
SO3(g)+NO(g) ΔH<0,从而实现物质转换降低能耗。某化学小组对该反应进行相关实验探究:在固定体积的密闭容器中,使用某种催化剂,改变原料气配比进行多组实验(各次实验的温度可能相同,也可能不同),测得NO2的平衡转化率如图所示:
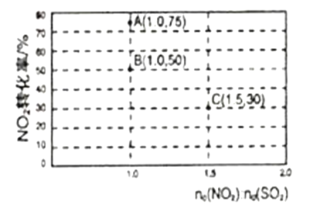
①如果要将图中B点改变为A点,应采取的措施是___;
②若B点对应实验中,SO2(g)的起始浓度为c0mol·L-1,经过tmin达到平衡状态,该时段反应速率υ(NO2)=____mol·L-1·min-1,化学平衡常数K=___;
③图中B、C两点对应的实验温度分别为TB和TC,通过计算判断TB__TC(填>、=、或<)。
(3)SCR(选择性催化还原)脱硝法是工业上消除氮氧化物的常用方法。主要反应原理为:4NO(g)+4NH3(g)+O2(g)![]() 4N2(g)+6H2O(g) ΔH<0。其他条件相同在甲、乙两种催化剂作用下,经过相同时间,NO转化率与温度的关系如图所示。
4N2(g)+6H2O(g) ΔH<0。其他条件相同在甲、乙两种催化剂作用下,经过相同时间,NO转化率与温度的关系如图所示。
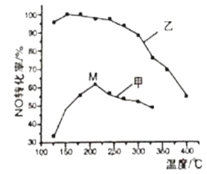
①工业上选择催化剂____(填“甲”或“乙”)原因是____。
②在催化剂甲的作用下,图中M点处(对应温度为210℃)NO的转化率___(填“可能是”、“一定是”或“一定不是”)该温度下的平衡转化率。高于210℃时NO的转化率降低的原因可能是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com