
下列分子中各原子都满足8电子稳定结构的化合物( )
|
| A. | CH4 | B. | CH2=CH2 | C. | CO2 | D. | N2 |
考点:
原子核外电子排布.
专题:
原子组成与结构专题.
分析:
对于ABn的共价化合物,各元素满足|化合价|+元素原子的最外层电子数=8,原子都满足最外层8电子结构,在化合物中氢原子属于2电子稳定结构,据此结合选项判断.
解答:
解:A、CH4中C原子满足8电子结构;H原子不满足8电子结构,故A错误;
B、CH2=CH2分子中H原子不满足8电子结构,故B错误;
C、CO2中C元素化合价为+4,C原子最外层电子数为4,所以4+4=8,分子中C原子满足8电子结构;O元素化合价为﹣2,O原子最外层电子数为6,所以|﹣2|+6=8,分子中O原子满足8电子结构,故C正确;
D、N2是单质,不是化合物,不符合题意,故D错误;
故选:C.
点评:
本题考查8电子结构的判断,共用电子对的偏移,难度不大,清楚元素化合价绝对值+元素原子的最外层电子层=8,则该元素原子满足8电子结构是关键,注意单质和离子化合物不适合.


科目:高中化学 来源: 题型:
下列反应常温时能自发进行,并既能用焓判据又能用熵判据解释的是( )
|
| A. | HCl+NH3═NH4Cl |
|
| B. | 2KClO3═2KCl+3O2↑ |
|
| C. | 2Na2O2+2H2O═4NaOH+O2↑ |
|
| D. | Ba(OH)2•8H2O+2 NH4Cl═BaCl2+NH3+10H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
在相同温度下,下列3个反应放出的热量分别以Q1、Q2、Q3表示,则Q1、Q2、Q3的关系是( )
(1)2H2(气)+O2(气)═2H2O(气)+Q1
(2)2H2(气)+O2(气)═2H2O(液)+Q2
(3)H2(气)+O2(气)═H2O(气)+Q3.
A. Q1>Q2,Q2=2Q3 B. Q1=Q2=Q3
C. Q1<Q2,Q3=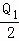 D. 无法比较
D. 无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
|
| A. | 将硫酸钡放入水中不能导电,所以硫酸钡不是电解质 |
|
| B. | CO2溶于水得到的溶液能导电,所以CO2是电解质 |
|
| C. | 金属能导电,所以金属是电解质 |
|
| D. | 固态的氯化钠不导电,熔融态的氯化钠可以导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素的一种同位素X的质量数为A,含N个中子,它与11H原子组成HmX分子.在a g HmX中所含质子的物质的量是( )
|
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,将Cl 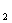 通入NaOH溶液中,反应得到NaCl、NaClO、NaClO
通入NaOH溶液中,反应得到NaCl、NaClO、NaClO 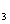 的混合液,经测定ClO - 与ClO
的混合液,经测定ClO - 与ClO 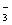 的离子个数比为1∶3,则Cl
的离子个数比为1∶3,则Cl 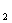 与NaOH反应时被还原的氯原子与被氧化的氯原子的个数比为
与NaOH反应时被还原的氯原子与被氧化的氯原子的个数比为
A.21∶5 B.4∶1
C.3∶1 D.11∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
某强酸性溶液X含有Ba 2+ 、Al 3+ 、N 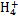 、Fe 2+ 、Fe 3+ 、C
、Fe 2+ 、Fe 3+ 、C 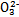 、S
、S 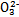 、S
、S 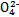 、Cl - 、N
、Cl - 、N 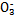 中的一种或几种,取该溶液进行实验,实验内容如下:
中的一种或几种,取该溶液进行实验,实验内容如下:
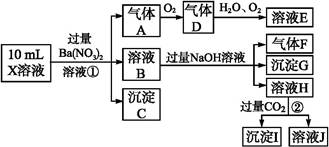
根据以上信息,回答下列问题:
(1)溶液X中除H + 外还肯定含有的离子是 ;不能确定是否含有的离子是 ,若要确定其中阳离子的存在,最可靠的化学方法是 。
(2)沉淀G的化学式为 。
(3)写出有关离子方程式:
步骤①中生成A 。
步骤②生成沉淀I 。
(4)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H + )="0.04" mol,而沉淀C物质的量0.07 mol,能说明(1)中不能确定的阴离子存在的理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com