
【题目】将一定量的锌与100mL 18.5mol/L H2SO4充分反应后,锌完全溶解,同时生成气体A 22.4L(标准状况).将反应后的溶液稀释至1L,测得溶液的pH=1,则下列叙述中错误的是( )
A.气体A为SO2和H2的混合物
B.反应中共消耗Zn 65g
C.气体A中SO2和H2的体积比为1:4
D.反应中共转移电子2mol
【答案】C
【解析】解:气体的物质的量= ![]() =1mol,反应前n(H2SO4)=18.5mol×0.1L=1.85mol,n(H+)=2n(H2SO4)=3.7mol,反应后n(H+)=0.1mol/L×1L=0.1mol, 浓硫酸和锌反应生成二氧化硫、稀硫酸和锌反应生成氢气,当浓硫酸浓度达到一定程度后,溶液变为稀硫酸,二者反应生成氢气,
=1mol,反应前n(H2SO4)=18.5mol×0.1L=1.85mol,n(H+)=2n(H2SO4)=3.7mol,反应后n(H+)=0.1mol/L×1L=0.1mol, 浓硫酸和锌反应生成二氧化硫、稀硫酸和锌反应生成氢气,当浓硫酸浓度达到一定程度后,溶液变为稀硫酸,二者反应生成氢气,
参加反应的n(H2SO4)=0.1L×18.5mol/L﹣0.05mol=1.8mol,
令混合气体中SO2、H2的物质的量分别为xmol、ymol,则:
Zn+ | 2H2SO4(浓)=ZnSO4+ | SO2↑+H2O |
x | 2x | x |
Zn+ | H2SO4(稀)=ZnSO4+ | H2↑ |
y | y | y |
![]() ,
,
解得 x=0.8,y=0.2,
A.通过以上分析知,混合气体是二氧化硫和氢气,故A正确;
B.反应中共消耗金属Zn的物质的量为1mol,其质量=65g/mol×1mol=65g,故B正确;
C.混合气体中SO2和H2的体积比等于其物质的量之比=0.8mol:0.2mol=4:1,故C错误;
D.反应中共消耗金属Zn的物质的量为1mol,转移电子为1mol×2=2mol,故D正确;
故选C.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应: ![]()
![]() +H2(g)△H=akJ.mol﹣1 . 经一段时间后达到平衡.反应过程中测定的部分数据见下表:
+H2(g)△H=akJ.mol﹣1 . 经一段时间后达到平衡.反应过程中测定的部分数据见下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
下列说法正确的是( )
A.反应在前20 min的平均速率为v(H2)=0.004molL﹣1min﹣1
B.保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08molL﹣1 , 则a<0
C.保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率为50.0%
D.相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2 , 达到平衡前v(正)>v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Ⅳ为一种重要化工中间体,其合成方法如下: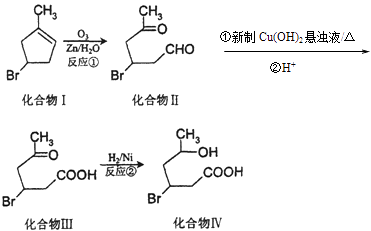
(1)化合物Ⅰ在核磁共振氢谱图吸收峰个数为;反应②的反应类型为 .
(2)化合物Ⅱ与新制Cu(OH)2悬浊液反应,写出该反应的化学方程式 .
(3)化合物I在NaOH醇溶液中加热反应得到化合物X,X的结构简式可能是 . (写出任意一种的结构简式).
(4)化合物III与足量NaOH水溶液加热反应的化学方程式为 .
(5)异黄樟油素 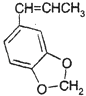 发生类似反应①的反应,得到乙醛和化合物Y,Y的结构简式为 .
发生类似反应①的反应,得到乙醛和化合物Y,Y的结构简式为 .
(6)有关上述化合物,说法不正确的是
A.1mol化合物Ⅲ,最多可与2molH2反应
B.化合物Ⅳ在一定条件下能与HBr反应
C.化合物Ⅰ能使酸性高锰酸钾溶液褪色
D.化合物Ⅳ在一定条件下能发生缩聚反应
E.化合物Ⅱ分子式为C6H11O2Br.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于50mL密度为1.1g/cm3的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如图所示.请依图回答下列问题: 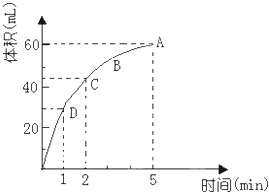
(1)放出一半气体所需要的时间为;
(2)A、B、C、D各点反应速率快慢的顺序是 .
(3)在5min后,收集到的气体体积不再增加,原因是 .
(4)过氧化氢溶液的初始物质的量浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为与水相关的部分转化关系(水作反应物或生成物,部分产物和反应条件未列出).下列说法错误的是( ) 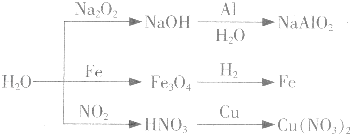
A.如图所示的反应均为氧化还原反应
B.比较镁、铁与水的反应条件,可知铁的金属性比镁弱
C.工业上常用NO2与水的反应原理制取硝酸
D.实验室中可用铜与稀硝酸反应制取NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶状液氢(主要成分是H2和CH4)有望用于未来的运载火箭和空间运输系统.实验测得101kPa时,1 molH2完全燃烧生成液态水,放出285.8kJ的热量;1 mol CH4完全燃烧生成液态水和CO2 , 放出890.3kJ的热量.下列热化学方程式书写正确的是( )
A.2H2(g)+O2(g)═2H2O(l)△H=﹣285.8 kJmol
B.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890.3 kJmol
C.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890.3 kJmol
D.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890.3 kJmol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)Fe(s)+CO2(g)(正反应是吸热反应),其平衡常数可表示为K= ![]() ,已知1100℃时K=0.263
,已知1100℃时K=0.263
(1)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值;平衡常数K值(选填“增大”“减小”或“不变”)
(2)1100℃时测得高炉中c(CO2)=0.025molL﹣1、c(CO)=0.1molL﹣1 , 在这种情况下,该反应是否处于化学平衡状态(选填“是”或“否”),此时,化学反应速率是v(正)v(逆)(选填“大于”“小于”或“等于”),其原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组利用图1装置进行CO2与饱和Na2CO3溶液反应制备NaHCO3 . 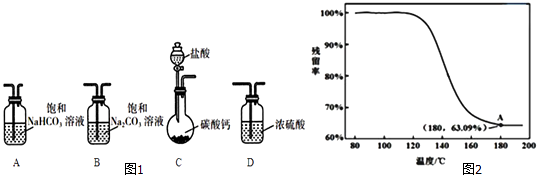
(1)选取必要的实验装置,正确的连接顺序为(填序号).
(2)为确定制得的固体样品是纯净的NaHCO3 , 小组同学提出下列实验方案:甲方案:将样品溶液与饱和澄清石灰水反应,观察现象.
乙方案:将样品溶液与BaCl2溶液反应,观察现象.
丙方案:测定pH法.
丁方案:热重分析法.
①判定甲方案(填“可行”或“不可行”).
②为判定乙方案的可行性,某同学用纯净的NaHCO3配制的溶液,与BaCl2溶液等体积混合进行实验,结果如下:
NaHCO3溶液 | 0.2molL﹣1 | 0.1molL﹣1 | 0.02molL﹣1 |
0.2molL﹣1 | 浑浊 | 浑浊 | 少许浑浊 |
0.1molL﹣1 | 浑浊 | 少许浑浊 | 无现象 |
0.02molL﹣1 | 少许浑浊 | 无现象 | 无现象 |
(i)此实验已可说明乙方案是不可行的.请结合以下数据,并通过计算说明产生浑浊的原因.
[己知:0.l molL﹣1 NaHCO3溶液电离出的c(CO32﹣)为0.001lmolL﹣1 , Ksp(BaCO3)=5.1×10﹣9]
答: .
(ii)产生浑浊(伴有气体产生)的离子方程式 .
③用pH计测定的丙方案如下:
取m克的固体样晶溶解于水配成V mL的溶液,用pH计测pH:
还应补充的实验是:
④进行丁方案实验,得到固体残留率随温度变化的曲线如图2所示,根据A点坐标得到的结沦是 .
(残留率= ![]() ×100%)
×100%)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com