
| A. | 一定有NO2和Cl2 | B. | 一定有SO2 和NO | ||
| C. | 可能有NO2 | D. | 一定有SO2,可能有NO |
分析 此混合气体无色透明,说明无Cl2、NO2;使品红溶液褪色的气体为SO2,把剩余气体排入空气中,很快变为红棕色,说明剩余气体中有NO,即原气体含NO,因此,混合气体中肯定有SO2和NO,肯定没有Cl2和NO2,不能确定是否含有CO2.
解答 解:该气体是无色的,则一定不能含有氯气(黄绿色)和NO2(红棕色).混合气体通过品红溶液后,品红溶液褪色,说明含有SO2.把剩余气体排入空气中,很快变为红棕色,说明含有NO,由于没有涉及到二氧化碳的性质和现象,则不能确定是否含有二氧化碳.
故选B.
点评 本题考查常见气体的检验和鉴别,是高考中的常见题型,属于中等难度的试题.该题需要注意的是进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理、验证即可.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 在“镀锌铁皮厚度测量”实验中,当锌在酸中完全溶解后,产生氢气的速率会显著减慢,可借此判断镀锌铁皮中锌镀层是否完全反应 | |
| B. | 亚硝酸钠外观与食盐相似,误食会引起中毒,因此不能用作食品添加剂 | |
| C. | 取试管向其加入适量CoCl2的盐酸溶液,将溶液进行稀释,可以观察到溶液颜色由粉红色变为蓝色 | |
| D. | 在两支试管中分别加1ml无水乙醇和1.5g苯酚固体,再加等量等体积的钠,比较乙醇、苯酚羟基上氢原子的活泼性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
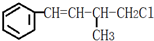 ,下列叙述错误的是( )
,下列叙述错误的是( )| A. | 1 mol 该有机物在加热和催化剂作用下,最多能和4 mol H2反应 | |
| B. | 该有机物能使溴水褪色,也能使酸性KMnO4溶液褪色 | |
| C. | 该有机物遇硝酸银溶液产生白色沉淀 | |
| D. | 该有机物在一定条件下能发生消去反应和取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

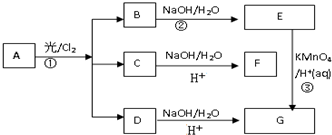
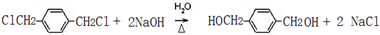 .
.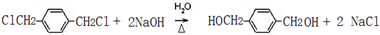 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | R在化合物中显+1价 | |
| B. | 最高价氧化物对应水化物的碱性:X>R | |
| C. | 原子半径X>Y>Z | |
| D. | 简单气态氢化物的热稳定性:Y<W |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若aXm+和bYn-两种离子电子层结构相同,则a-b=n-m | |
| B. | 24Mg32S中电子总数与中子总数之比为1:1 | |
| C. | CO2和PC13分子中各原子最外层都满足8电子结构 | |
| D. | ⅥA族元素的氢化物中,稳定性最好的其沸点也最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
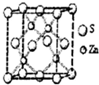 化学材料的研发和使用,为开发太阳能资源,寻求经济发展的新动力提供有力支撑,请根据你所学知识回答:
化学材料的研发和使用,为开发太阳能资源,寻求经济发展的新动力提供有力支撑,请根据你所学知识回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com