
| A. | pH=1的溶液中:Na+、K+、SO32-、MnO4- | |
| B. | pH=7的溶液中:Na+、Al3+、Cl-、SO42- | |
| C. | pH>12的溶液中:Na+、K+、SO42-、AlO2- | |
| D. | pH=0的溶液中:Na+、K+、NO3-、ClO- |
分析 A.pH=1的溶液呈酸性;
B.pH=7的溶液呈中性,水解的离子不能大量共存;
C.pH>12的溶液呈碱性;
D.pH=0的溶液呈酸性.
解答 解:A.pH=1的溶液呈酸性,酸性条件下SO32-、MnO4-发生氧化还原反应而不能大量共存,故A错误;
B.pH=7的溶液呈中性,Al3+水解呈酸性,不能大量共存,故B错误;
C.pH>12的溶液呈碱性,碱性条件下离子之间不发生任何反应,可大量共存,故C正确;
D.pH=0的溶液呈酸性,酸性条件下ClO-不能大量共存,故D错误.
故选C.
点评 本题考查离子的共存,为高考高频考点,侧重复分解反应、氧化还原反应的离子共存的考查,注意把握习题中的信息及常见离子之间的反应,题目难度不大.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:实验题
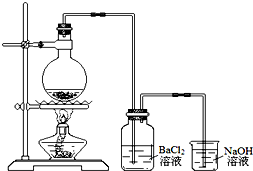 某学习小组探究铜跟浓硫酸反应的情况.取6.4g铜片和10mL 18mol•L-1的浓硫酸放在圆底烧瓶中,按如图所示装置进行实验.
某学习小组探究铜跟浓硫酸反应的情况.取6.4g铜片和10mL 18mol•L-1的浓硫酸放在圆底烧瓶中,按如图所示装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
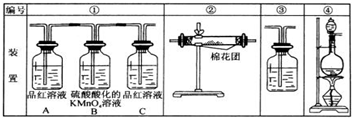
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4(aq) | B. | HCl(aq) | C. | Fe2(SO4)3(aq) | D. | CuSO4(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
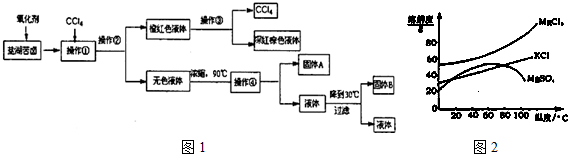
| 化学式 | BaCO3 | BaSO4 | Ca(OH)2 | MgCO3 | Mg(OH)2 |
| Ksp | 8.1×10一9 | 1.08×10一10 | 1.0×10一4 | 3.5×10一5 | 1.6×10一11 |
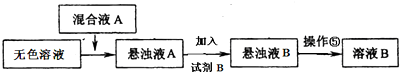
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将25gKCl溶液蒸干得到5gKCl固体,则原溶液中溶质的质量分数为20% | |
| B. | 某物质中只含有一种元素,则该物质一定是纯净物 | |
| C. | 只有一种元素的阳离子和一种元素的阴离子构成的物质一定是纯净物 | |
| D. | 盐形成的溶液中,既不能电离出H+,也不能电离出OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | <1:1 | C. | ≥1:1 | D. | 任意比 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com