
为了测定酸碱反应的中和热,计算时至少需要的数据是
①酸的浓度和体积;②碱的浓度和体积;③比热容;④反应后溶液的质量;⑤生成水的物质的量;⑥反应前后的温度变化;⑦操作所需时间;
A.①②③⑥⑦ B.①③④⑤ C.③④⑤⑥ D.①②③④⑤⑥
科目:高中化学 来源:2014-2015浙江省高一上学期第三次月考化学试卷(解析版) 题型:实验题
(10分)某同学帮助水质检测站配制800mL 1 mol·L-1NaOH溶液备用。
(1)该同学应选择的玻璃仪器除了烧杯、量筒、玻璃棒、胶头滴管外,还有 。

(2)其操作步骤如下图所示,则如图操作应在下图中的 (填选项字母)之间。
A.②与③ B.①与② C.④与⑤ D.③与④
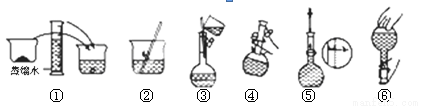
(3)该同学应用托盘天平称取NaOH固体 g,用质量为33.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在下图中选出能正确表示游码位置的选项 (填选项字母)。

(4)下列操作对所配溶液浓度大小有何影响 (填“偏大”、“偏小”或“无影响”)。
①定容时,仰视读数,浓度会 ;
②转移溶液过程中,未洗涤玻璃棒和烧杯,浓度会 ;
③容量瓶未干燥,浓度会 ;
④定容摇匀后发现溶液凹面低于刻度线,继续加水至刻度线,浓度会 。
(5)配制溶液的实际操作过程中,动作要快,否则由于 ,会使配制的NaOH溶液的浓度比1 mol·L-1 ______(填“大”或“小”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高二上学期第三次月考化学试卷(解析版) 题型:选择题
下列各电离方程式中,书写正确的是
A.CH3COOH === H++CH3COO- B.KHSO4  K++H++SO42-
K++H++SO42-
C.Al(OH)3 Al3++3OH- D.NaH2PO4
Al3++3OH- D.NaH2PO4  Na++H2PO4-
Na++H2PO4-
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省乐清市高二上学期10月月考化学试卷(解析版) 题型:选择题
下列关于判断过程的方向的说法正确的是
A.所有自发进行的化学反应都是放热反应
B.判断化学反应能否自发进行,必须综合考虑反应的焓变和熵变
C.自发反应一定是熵增大,非自发反应一定是熵减小的反应
D.同一物质的固、液、气三种状态中固体的熵值最大
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省乐清市高二上学期10月月考化学试卷(解析版) 题型:选择题
如图装置中,小试管内为红墨水,具支试管内盛有一定量pH=4的雨水和生铁片。实验时观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面。下列说法正确的是

A.生铁片中的碳是原电池的阳极,发生还原反应
B.雨水酸性较强,生铁片仅发生析氢腐蚀
C.墨水液面回升时,碳电极反应式为O2+2H2O+4e-===4OH-
D.具支试管中溶液pH逐渐减小
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省乐山市高三第一次调查研究考试理综化学试卷(解析版) 题型:填空题
(14分)
某混合物的水溶液,可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH、Cl-、CO、SO,现分别取100 mL的两等份溶液进行如下实验:
①第一份加过量NaOH溶液后加热,收集到0.02 mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、干燥、灼烧后,得到1.02 g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65 g固体。
依据实验回答下列问题:
(1)由①可知一定存在的离子为 ,其浓度为 mol·L-1。
(2)写出②中产生沉淀的离子方程式 。
(3)由③可知一定存在的离子为 ,其浓度为 mol·L-1。
(4)综合上面三个实验,该混合物的水溶液中一定不存在的离子是 (填离子符号)。
(5)某同学通过分析认为该溶液中一定存在K+,他的理由是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省乐山市高三第一次调查研究考试理综化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的数值,下列说法中正确的是
A.在0.1 mol NaHSO4晶体中阳离子与阴离子总数为0.3 NA
B.22.4L NH3中含有的原子总数为4NA
C.1mol单质钠在常温下或点燃条件下与O2完全反应转移的电子数都为NA
D.常温条件下,等物质的量浓度的HCl溶液和NaOH溶液混合,溶液pH=7
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市五校高三上学期联合教学质量调研化学试卷(解析版) 题型:选择题
下列关于0.10 mol/L NaHCO3溶液的说法正确的是
A.溶质的电离方程式为:NaHCO3→Na++H++CO32-
B.25 ℃时,加水稀释后,n(H+)与n(OH-)的乘积变大
C.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3- )+c(CO32-)
D.温度升高,c(HCO3- )增大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省高三上学期12月月考理综化学试卷(A)(解析版) 题型:简答题
【化学---选修3物质结构与性质】15分
卤族元素的单质和化合物很多,一氯化碘(ICl)、三氯化碘(ICl3),由于它们的性质与卤素相似,因此被称为卤素互化物。请利用所学物质结构与性质的相关知识回答下列问题:
(1)卤族元素位于周期表的 区 I-的最外层电子排布式为
(2)已知高碘酸有两种形式,化学式分别为H5IO6  和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6 HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为 。
和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6 HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为 。
(3)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列 式发生。A.CsICl2=CsCl+ICl B.CsICl2 =CsI +Cl2
(4)用海带制碘时,生成的粗碘中常混有ICl,可加入KI加热升华提纯,
发生化学反应的化学方程式为
(5)ClO2—的空间构型为 型,中心氯原子的杂化轨道类型为 ,
(6)已知CaF2晶体(见图)的密度为ρg/cm3 .NA为阿伏加德罗常数,距离最近且相等的两个Ca2+核间距为a cm,则CaF2的摩尔质量为

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com