
向50 mL 0.018 mol·L-1 AgNO3溶液中加入50 mL 0.02 mol·L-1盐酸。已知AgCl(s)的溶度积常数Ksp= 1×10-10,混合后溶液的体积变化忽略不计。下列说法不正确的是( )
| A.混合后,溶液中肯定有沉淀生成 |
| B.沉淀生成后溶液中Ag+的浓度为10-5 mol·L-1 |
| C.沉淀生成后溶液的pH=2 |
| D.混合后,升高温度,溶液中Ag+的浓度增大 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-离子浓度分别为A mol·L-1与B mol·L-1,则A和B的关系为
| A.A>B | B.A=10-4B | C.B=10-4A | D.A=B |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温时,将V1 mL c1 mol·L-1的氨水滴加到V2 mL c2 mol·L-1的盐酸中,下述结论中正确的是( )
| A.若混合溶液的pH=7,则c1V1>c2V2 |
B.若V1=V2,c1=c2,则混合液中c(N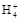 )=c(Cl-) )=c(Cl-) |
C.若混合液的pH=7,则混合液中c(N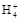 )>c(Cl-) )>c(Cl-) |
| D.若V1=V2,且混合液的pH<7,则一定有c1<c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
25 ℃时,在浓度均为0.01 mol·L-1的NaCN与HCN组成的混合溶液中,测得c(Na+)>c(CN-),则下列描述中不正确的是( )
| A.该溶液的pH<7 |
| B.CN-的水解程度大于HCN的电离程度 |
| C.c(CN-)+c(HCN)=0.02 mol·L-1 |
| D.c(CN-)+c(OH-)=0.01 mol·L-1+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列关于难溶物之间转化的说法中错误的是( )
| A.AgCl不溶于水,不能转化为AgI |
| B.两种难溶物的Ksp相差越大,难溶物就越容易转化为更难溶的物质 |
| C.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于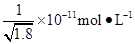 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列离子方程式中,属于水解反应的是( )
A.HCOOH+H2O HCOO-+H3O+ HCOO-+H3O+ |
B.CO2+H2O HCO3-+H+ HCO3-+H+ |
C.CO32-+H2O HCO3-+OH- HCO3-+OH- |
D.HS-+H2O S2-+H3O+ S2-+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
现有0.4 mol·L-1HA溶液和0.2 mol·L-1NaOH溶液等体积混合组成的混合溶液。下列有关推断正确的是( )
A.若该溶液中HA的电离能力大于A-的水解能力,则有c(Na+)>c(A-)> c(HA)> c(H+)>c(OH-)
B.若该溶液中A-的水解能力大于HA的电离能力,则有c(A-)>c(HA)>c(Na+)> c(OH-)>c(H+)
C.无论该溶液呈酸性还是碱性,都有c(Na+)+c(H+)=c(A-)+c(OH-)
D.无论该溶液呈酸性还是碱性,都有c(Na+)=c(A-)+c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是三种酸的电离平衡常数,若已知这些酸可发生如下反应:
①NaCN+HNO2=HCN+NaNO2,
②NaCN+HF=HCN+NaF,
③NaNO2+HF=HNO2+NaF。
由此可判断下列叙述中,不正确的是( )
| A.HF的电离平衡常数为7.2×10-4 |
| B.HNO2的电离平衡常数为4.9×10-10 |
| C.根据①③两个反应即可知三种酸的相对强弱 |
| D.HNO2的电离平衡常数比HCN大,比HF小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温时,下列叙述正确的是( )
| A.稀释pH=10的氨水,溶液中所有离子的浓度均降低 |
| B.pH均为5的HCl和NH4Cl溶液中,水的电离程度相同 |
| C.NaOH和CH3COONa的混合溶液中,c(Na+)+c(H+)=c(OH-)+c(CH3COO-) |
| D.分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com