
| 1 |
| 2 |

| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、一定条件下足量的Fe粉与浓硫酸反应,转移电子数一定为3NA |
| B、常温常压下,15g甲基(-CH3)所含的中子数为6NA |
| C、在1L的碳酸钠溶液中,若c(CO32-)=1mol?L-1,则Na+个数为NA |
| D、含4NA个离子的固体Na2O2溶于水配成1L溶液,所得溶液中Na+的浓度为1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀硫酸与铁反应: 2Fe+6H+═2Fe3++3H2↑ |
| B、2 mol/L的AlCl3溶液和7 mol/L的Na0H溶液等体积均匀混合:2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O |
| C、Ba(0H)溶液中加人少量的NaHS04溶液:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
| D、NaHC03 的水解:HCO3-+H2O?CO32-+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
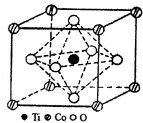 MnO2是碱锰电池材料中最普通的正极材料之一,在MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能.
MnO2是碱锰电池材料中最普通的正极材料之一,在MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能.| 元素 | Mn | Fe | |
| 电离能/kJ?mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ?mol-1) | 786 | 715 | 3 401 |


查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若V1>V2,则说明HA的酸性比HB的酸性弱 |
| B、因为两种酸溶液的pH相等,故V1一定等于V2 |
| C、若V1>V2,则说明HA的酸性比HB的酸性强 |
| D、因为两种酸溶液的pH相等,所以HA与HB的酸性相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NO3-、Cl-、Na+、H+ |
| B、AlO2-、K+、ClO- CO32- |
| C、Ca2+、Cl-、SO42-、Na+ |
| D、SO42-、Fe2+、OH-、NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com