
| A. | ①③ | B. | ③④ | C. | ①② | D. | ①③④ |
分析 硝酸、硫酸的浓度不同,性质不同,与金属发生反应时,发生不同的氧化还原反应,据此解答.
解答 解:①Cu与HNO3溶液中,若为浓硝酸,发生Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O,若为稀硝酸,则发生3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,与浓度有关,故选;
②Cu与FeCl3溶液中发生反应:Cu+2FeCl3═2FeCl2+CuCl2,与浓度无关,故不选;
③Zn与H2SO4溶液中,若为稀硫酸,发生Zn+H2SO4═ZnSO4+H2↑,若为浓硫酸,则发生Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O,与浓度有关,故选;
④Fe与HCl溶液中,发生反应:Fe+2HCl=FeCl2+H2↑,与浓度无关,故不选;
故选:A.
点评 本题考查了反应物浓度对反应的影响,熟悉硫酸、硝酸性质即可解答,题目难度不大.


 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,化合物A在体内脱氢酶的作用下会氧化为有害物质GHB.如图是关于化合物A的一种制备方法及由A引发的一系列化学反应.
,化合物A在体内脱氢酶的作用下会氧化为有害物质GHB.如图是关于化合物A的一种制备方法及由A引发的一系列化学反应.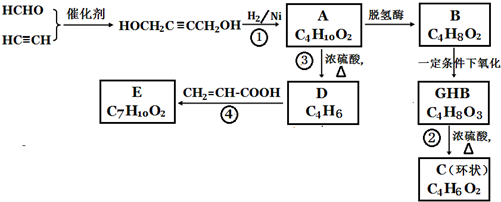
 +H2O.
+H2O.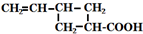 外,还有(写出结构简式)
外,还有(写出结构简式)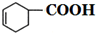 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 比较镁、铝金属性:镁、铝(除氧化膜)分别放入4mol•L-1NaOH溶液中 | |
| B. | 比较氯、溴非金属性:氯气通入溴化钠溶液中 | |
| C. | 比较Cu、Fe2+的还原性:Cu加入FeCl3溶液中 | |
| D. | 比较高锰酸钾、氯气的氧化性:高锰酸钾中加入浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单地说,金属的冶炼就是把金属单质从其矿物中分离出来 | |
| B. | 金属冶炼过程中,被冶炼的金属只能被氧化 | |
| C. | 金属冶炼过程中,被冶炼的金属只能被还原 | |
| D. | 金属冶炼过程中,被冶炼的金属既可被氧化,也可被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
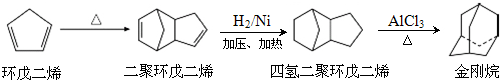
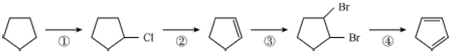
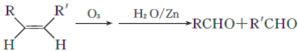
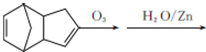
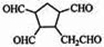 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO | B. | N2O3 | C. | N2O | D. | N2O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com