
【题目】向20mL某浓度的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:

(1)分别用离子方程式表示图中OA段、AB段的反应原理_________________________、_____________________________.
(2)最大沉淀质量为_____g
(3)所用AlCl3溶液的物质的量浓度是______________
(4)当所得沉淀量为0.39g时,用去NaOH溶液的体积是_____mL或_____mL。
【答案】 图中OA段:Al3++3OH-=Al(OH)3↓ AB段:Al(OH)3+OH-=AlO2-+2H2O 0.78 g 0.5mol/L 7.5 mL 17.5 mL。
【解析】(1)开始AlCl3与NaOH反应Al3++3OH-= Al(OH)3↓,生成Al(OH)3沉淀,NaOH量逐渐增多,Al(OH)3量逐渐增大,到A点时氢氧化钠将AlCl3恰好完全沉淀时,Al(OH)3沉淀达到最大量,故图中OA段离子反应为:Al3++3OH-=Al(OH)3↓;Al(OH)3沉淀达到最大量后,再加NaOH,发生Al(OH)3+OH-=AlO2-+2H2O,沉淀量又逐渐减少,到B点时Al(OH)3与NaOH恰好完全反应生成NaAlO2,沉淀完全溶解消失,故图中AB段离子反应为:Al(OH)3+OH-=AlO2-+2H2O;(2)由于A→B消耗的氢氧化钠溶液体积为5mL,消耗NaOH为0.005L×2mol/L=0.01 mol,根据方程式可知n[Al(OH)3]=0.01mol,氢氧化铝的质量=0.01mol×78g/mol=0.78g;(3)根据铝原子守恒,则n(AlCl3)=n[Al(OH)3]=0.01mol,故氯化铝的物质的量浓度=![]() =0.5mol/L;(5)0.39 g Al(OH)3的物质的量=
=0.5mol/L;(5)0.39 g Al(OH)3的物质的量=![]() =0.005mol。当NaOH溶液不足时,生成0.39 g Al(OH)3所需NaOH的物质的量为0.005mol×3=0.015 mol,需要NaOH溶液的体积=
=0.005mol。当NaOH溶液不足时,生成0.39 g Al(OH)3所需NaOH的物质的量为0.005mol×3=0.015 mol,需要NaOH溶液的体积=![]() =0.0075L=7.5mL;当NaOH溶液过量时,还剩余0.39 g Al(OH)3,剩余0.39 g Al(OH)3溶解可以消耗0.005molNaOH,故共消耗NaOH的物质的量=0.02L×2mol/L-0.005mol=0.035 mol,需要NaOH溶液的体积=
=0.0075L=7.5mL;当NaOH溶液过量时,还剩余0.39 g Al(OH)3,剩余0.39 g Al(OH)3溶解可以消耗0.005molNaOH,故共消耗NaOH的物质的量=0.02L×2mol/L-0.005mol=0.035 mol,需要NaOH溶液的体积=![]() =0.0175L=17.5mL,故答案为:7.5 mL或17.5 mL。
=0.0175L=17.5mL,故答案为:7.5 mL或17.5 mL。


科目:高中化学 来源: 题型:
【题目】聚芳酯(PAR)是分子主链上带有苯环和酯基的特种工程塑料,在航空航天等领域具有广泛应用.下图是利用乙酰丙酸( ![]() )合成聚芳酯E的路线:
)合成聚芳酯E的路线: 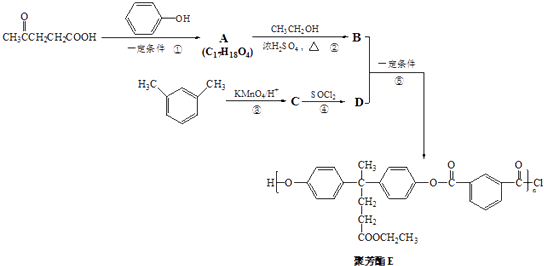
已知:① ![]()
② ![]()
(R、R′表示烃基)
(1)乙酰丙酸中含有的官能团是羰基和(填官能团名称).
(2)下列关于有机物A的说法正确的是(填字母序号).a.能发生加聚反应 b.能与浓溴水反应
c.能发生消去反应 d.能与H2发生加成反应
(3)A→B的化学方程式为
(4)D的结构简式为 .
(5)C的分子式为 , 符合下列条件的C的同分异构体有种.①能发生银镜反应②能与NaHCO3溶液反应③分子中有苯环,无 ![]() 结构
结构
在上述同分异构体中,有一类有机物分子中苯环上只有2个取代基,写出其中任一种与足量NaOH溶液共热反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界卫生组织(WHO)将ClO2定为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有广泛应用.ClO2属于( )
A. 酸B. 氧化物C. 碱D. 盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】外界条件相同的理想气体,决定其所占体积大小的主要因素是( )
A. 分子直径的大小 B. 分子数目的多少
C. 组成分子的原子个数 D. 分子间距离的大小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1molL﹣1某一元酸HA在水中有0.01%发生电离,下列叙述正确的是( )
A.该溶液的PH=4
B.升高温度,溶液的PH增大
C.稀释时溶液中所有离子的浓度都减少
D.此酸的电离平衡常数约为1×10﹣9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】列式计算:标准状况下,22.4LHCl气体溶于50mL水再配成250mL溶液,
(1)求溶质的物质的量?
(2)求所得盐酸的物质的量浓度?
(3)若将此溶液再稀释成1L溶液,求稀释后盐酸的物质的量浓度?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完全沉淀等物质的量浓度的NaCl、AlCl3溶液中的Cl-,消耗等物质的量浓度的AgNO3溶液的体积比为1:1,则上述溶液的体积比为
A. 1:1 B. 9:1 C. 6:2 D. 3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个密闭容器中,盛有N2和H2 , 它们的起始浓度分别是1.8molL﹣1和5.4molL﹣1 , 在一定的条件下它们反应生成NH3 , 10min后测得N2的浓度是0.8molL﹣1 , 则在这10min内NH3的平均反应速率是( )
A.0.1molL﹣1min﹣1
B.0.3molL﹣1min﹣1
C.0.2molL﹣1min﹣1
D.0.6molL﹣1min﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com