
2- 4 |
| H+ |
| 转换 |
2- 7 |
| Fe2+ |
| 还原 |
| OH- |
| 沉淀 |
2- 4 |
2- 7 |
| 10 |
| 11 |
| A、溶液颜色保持不变,说明上述可逆反应达到平衡状态 |
| B、若用绿矾(FeS04?7H20)(M=278)作还原剂,处理1 L废水,至少需要917.4 g |
| C、常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=6 |
| D、常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5 |
| 10 |
| 11 |
| 10 |
| 11 |
| 28.6g |
| 52g/mol |
| 10 |
| 11 |
| 10 |
| 11 |
| 10 |
| 11 |
| 1 |
| 2 |
| c(Cr2O72-) |
| c2(CrO42-)c2(H+) |


科目:高中化学 来源: 题型:
| A、将S02通入酸性KMnO4溶液:2MnO4-+5S02+2H20?2Mn2++5SO42-+4H+ |
| B、将Na2CO3溶液滴入等浓度等体积的盐酸中:C032-+H+?HCO3- |
| C、过氧化钠固体与水反应,2022-+2H20?40H-+02↑ |
| D、硫化钠水溶液呈碱性的原因:S2-+2H20?H2S+20H- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 气体 | CH4 | C2H6 | C2H4 | C3H6 |
| 燃烧热/kJ?mol-1 | Q1 | Q2 | Q3 | Q4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
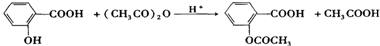
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | Ⅰ | Ⅱ | Ⅲ |
| A | 稀氨水 | Al3+ | Mg2+ |
| B | 新制氯水、CCl4 | I- | Cl- |
| C | KSCN溶液、新制氯水 | Fe2+ | Fe3+ |
| D | 稀盐酸、BaCl2溶液 | SO42- | SO32- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3溶液 |
| B、NaOH溶液 |
| C、NH4Cl溶液 |
| D、NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
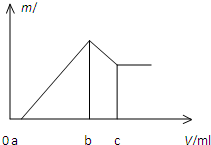 将镁、铝的混合物0.1mol 溶于100mL 2mol/L H2SO4溶液中,然后再滴加1mol/L 的NaOH溶液,沉淀质量m 随加入NaOH溶液的体积V 变化情况如图所示,计算:(1)当a=160mL时,金属混合物中n(Mg)=
将镁、铝的混合物0.1mol 溶于100mL 2mol/L H2SO4溶液中,然后再滴加1mol/L 的NaOH溶液,沉淀质量m 随加入NaOH溶液的体积V 变化情况如图所示,计算:(1)当a=160mL时,金属混合物中n(Mg)=查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com