
 向20mL某浓度的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:
向20mL某浓度的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:分析 (1)开始AlCl3与NaOH反应Al3++3OH-=Al(OH)3↓,生成Al(OH)3沉淀,NaOH量逐渐增多,Al(OH)3量逐渐增大,到A点时氢氧化钠将AlCl3恰好完全沉淀时,Al(OH)3沉淀达到最大量;
(2)随后再加NaOH,发生Al(OH)3+OH-=AlO2-+2H2O,沉淀量又逐渐减少,到B点时Al(OH)3与NaOH恰好完全反应生成NaAlO2,沉淀完全溶解消失;
由于A→B消耗的氢氧化钠溶液体积为5ml,消耗NaOH为0.005L×2mol/L=0.01 mol,根据方程式可知n[Al(OH)3]=0.01mol,根据m=nM计算氢氧化铝的质量;根据铝原子守恒则n(AlCl3)=0.01 mol,根据c=$\frac{n}{V}$计算氯化铝的物质的量浓度;
(3)0.39 g Al(OH)3的物质的量=$\frac{0.39g}{78g/mol}$=0.005mol.当NaOH溶液不足时,生成0.39 g Al(OH)3所需NaOH的物质的量为0.015 mol;当NaOH溶液过量时,还剩余0.39 g Al(OH)3,剩余0.39 g Al(OH)3溶解可以消耗0.005molNaOH,故共消耗NaOH的物质的量=0.02L×2mol/L-0.005mol=0.035 mol,根据V=$\frac{n}{c}$计算NaOH溶液的体积.
解答 解:(1)开始AlCl3与NaOH反应Al3++3OH-=Al(OH)3↓,生成Al(OH)3沉淀,NaOH量逐渐增多,Al(OH)3量逐渐增大,到A点时氢氧化钠将AlCl3恰好完全沉淀时,Al(OH)3沉淀达到最大量,由于A→B消耗的氢氧化钠溶液体积为5ml,消耗NaOH为0.005L×2mol/L=0.01 mol,根据方程式可知n[Al(OH)3]=0.01mol,氢氧化铝的质量=0.01mol×78g/mol=0.78g,
故答案为:0.78;
(2)根据铝原子守恒,则n(AlCl3)=n[Al(OH)3]=0.01mol,
故氯化铝的物质的量浓度=$\frac{0.01mol}{0.02L}$=0.5mol/L,
故答案为:0.5mol/L;
(3)0.39 g Al(OH)3的物质的量=$\frac{0.39g}{78g/mol}$=0.005mol.
当NaOH溶液不足时,生成0.39 g Al(OH)3所需NaOH的物质的量为0.005mol×3=0.015 mol,需要NaOH溶液的体积=$\frac{0.015mol}{2mol/L}$=0.0075L=7.5mL;
当NaOH溶液过量时,还剩余0.39 g Al(OH)3,剩余0.39 g Al(OH)3溶解可以消耗0.005molNaOH,故共消耗NaOH的物质的量=0.02L×2mol/L-0.005mol=0.035 mol,需要NaOH溶液的体积=$\frac{0.035mol}{2mol/L}$=0.0175L=17.5mL,
故答案为:7.5或17.5.
点评 本题是AlCl3与NaOH反应与图象相结合的计算问题,考查了大家对图象的解读能力,分析问题能力、计算能力等,难度中等,本题解决的关键是明确NaOH溶液逐滴加入到AlCl3溶液中的反应情况.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
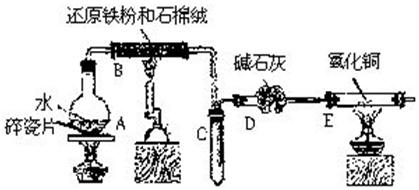
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯 | B. | 1,3-丁二烯 | C. | 丙炔 | D. | 2-丁炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 物质 |  甘蔗 |  生石灰 |  液氨 |  亚硝酸钠 |
| 用途 | 甘蔗渣可以制得酒精 | 干燥剂、抗氧化剂 | 制冷剂 | 食品防腐剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 赤铁矿的主要成分是Fe3O4 | |
| B. | 铁与水蒸气在高温下反应得产物为Fe2O3和H2 | |
| C. | 在空气中灼烧Fe(OH)3最终得到Fe2O3 | |
| D. | Cl2与过量的铁粉反应生成FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3 mol/L | B. | 0.15 mol/L | C. | 0.25 mol/L | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题.
下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题.| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | F | ||||
| 3 | Na | Mg | Al | S | Cl | Ar |
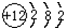 ,其对应的元素符号是Mg;
,其对应的元素符号是Mg;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com