

 N2(g)+3H2(g),反应时间(t)与容器内气体总压强(p)的数据见下表
N2(g)+3H2(g),反应时间(t)与容器内气体总压强(p)的数据见下表| 时间t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 总压强p 100 kPa | 5 | 5.6 | 6.4 | 6.8 | 7 | 7 |
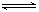 SO3(g)+NO(g) ΔH=-41.8kJ/mol(2分)
SO3(g)+NO(g) ΔH=-41.8kJ/mol(2分) N2H5++OH- (2分)
N2H5++OH- (2分)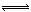 2SO3(g) ΔH=-196.6kJ?mol?1,根据图2可得:2NO(g)+O2(g)=2NO2(g) ΔH=-113.0kJ?mol?1,根据盖斯定律可得NO2(g)+SO2(g)
2SO3(g) ΔH=-196.6kJ?mol?1,根据图2可得:2NO(g)+O2(g)=2NO2(g) ΔH=-113.0kJ?mol?1,根据盖斯定律可得NO2(g)+SO2(g)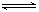 SO3(g)+NO(g) ΔH=1/2ΔH1—1/2ΔH2=-41.8kJ?mol?1
SO3(g)+NO(g) ΔH=1/2ΔH1—1/2ΔH2=-41.8kJ?mol?1 N2(g)+3H2(g)
N2(g)+3H2(g) N2H5++OH-
N2H5++OH- 

科目:高中化学 来源:不详 题型:单选题
| A.1s22s22p2 | B.1s22s22p5 |
| C.1s22s22p63s2 | D.1s22s22p63s1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaF | B.MgCl2 | C.NaCl | D.CaCl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碘和干冰的升华 | B.二氧化硅和生石灰的熔化 |
| C.氯化钠和铁的熔化 | D.食盐和冰醋酸的熔化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.甲烷的燃烧热ΔH为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g) CO2(g)+2H2O(g) ΔH="-890.3" kJ·mol-1 CO2(g)+2H2O(g) ΔH="-890.3" kJ·mol-1 |
B.含20.0 g的NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ 的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq) CH3COONa(aq)+H2O(l) ΔH="-57.4" kJ·mol-1 CH3COONa(aq)+H2O(l) ΔH="-57.4" kJ·mol-1 |
C.上图是298 K、101 Pa时CO和H2合成CH3OH(g)的反应过程中能量变化的曲线图,则该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g) ΔH="+91" kJ·mol-1 CH3OH(g) ΔH="+91" kJ·mol-1 |
D.已知:2Zn(s)+O2(g) 2ZnO(s) ΔH="-701.0" kJ/mol 2ZnO(s) ΔH="-701.0" kJ/mol |
 2HgO(s) ΔH="-181.6" kJ/mol
2HgO(s) ΔH="-181.6" kJ/mol ZnO(s)+Hg(l) ΔH="-259.7" kJ·mol-1
ZnO(s)+Hg(l) ΔH="-259.7" kJ·mol-1查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②③⑤ | B.②⑤⑥ | C.②⑥ | D.②③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NH4Cl为共价化合物 |
| B.N2分子中含有一对共用电子对 |
| C.Na2O2既含有离子键又含有非极性键 |
| D.电解水与电解熔融NaCl时破坏的化学键类型相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com