
Q、R、X、Y、Z为前20号元素中的五种,Q的低价氧化物与X单质分子的电子总数相等,R与Q同族,Y和Z的离子与Ar原子的电子层结构相同且Y的原子序数小于Z。
(1)Q的最高价氧化物,其固态属于________晶体,俗名为______________。
(2)R的氢化物分子的空间构型是____________;属于________分子(填“极性”或“非极性”);它与X形成的化合物可作为一种重要的陶瓷材料,其化学式是________。
(3)X的常见氢化物的空间构型是____________;它的另一氢化物X2H4是一种火箭燃料的成分,其电子式是________________。
(4)Q分别与Y、Z形成的共价化合物的化学式是________________和________________;Q与Y形成的分子的电子式是____________,属于________分子(填“极性”或“非极性”)。
(1)分子 干冰 (2)正四面体 非极性 Si3N4 (3)三角锥形 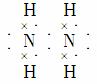 (4)CS2 CCl4
(4)CS2 CCl4 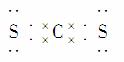 非极性
非极性
解析 本题综合考查物质结构知识。根据题设条件可推知Q为C,R为Si,X为N,Y为S,Z为Cl。
(1)C的最高价氧化物为CO2,固态时是分子晶体,其俗名为干冰。
(2)Si的氢化物为SiH4,根据CH4的空间构型可知SiH4的空间构型为正四面体,SiH4分子中正负电荷重心重合,属于非极性分子。Si最外层有4个电子,N最外层有5个电子,它们形成化合物时,Si为+4价,N为-3价,其化学式为Si3N4。
(3)N的常见氢化物为NH3,其空间构型为三角锥形。根据N、H原子的成键原则,可得N2H4的结构简式为H2N—NH2,根据其结构简式可推写出其电子式。
(4)C与S可形成CS2,根据CO2的结构可写出CS2的电子式并知其为非极性分子。C与Cl形成CCl4分子。


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
指出下列保健食品的作用:
(1)葡萄糖酸钙口服液____________;
(2)盖中钙__________;
(3)葡萄糖酸锌口服液__________;
(4)乳酸亚铁__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验。请回答:
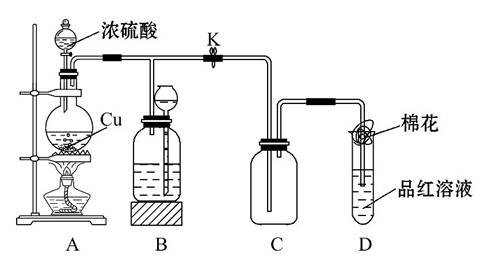
(1)装置A中发生反应的化学方程式为___________________________。
(2)装置D中试管口放置的棉花中应浸一种液体,这种液体是__________,其作用是___________________________。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是_____________
___________________________________。
B中应放置的液体是(填字母)________。
A.水 B.酸性KMnO4溶液
C.浓溴水 D.饱和NaHSO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质各自形成的晶体,均属于分子晶体的化合物的是( )
A.NH3、HD、C10H8 B.PCl3、CO2、H2SO4
C.SO2、SiO2、P2O5 D.CCl4、Na2S、H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
水的沸点是100℃,硫化氢的分子结构跟水相似,但它的沸点却很低,是-60.7℃,引起这种差异的主要原因是( )
A.范德华力 B.共价键
C.氢键 D.相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
2008年9月25日,“神舟”七号太空飞船被“长征2号”F型火箭送入太空。“神舟”七号太空飞船的外壳是一种新型结构陶瓷材料,它的主要成分是氮化硅。氮化硅是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定。
(1)氮化硅晶体属于________晶体。
(2)下列物质融化时,所克服的微粒间作用力与氮化硅熔化时所克服的微粒间作用力相同的是________。
①单质I2和金刚石 ②晶体硅和二氧化硅
③冰和干冰 ④金刚石和碳化硅
(3)已知氮化硅的晶体结构中,原子间都以单键相连,且氮原子与氮原子、硅原子与硅原子不直接相连,同时每个原子都满足8电子稳定结构,请写出氮化硅的化学式:________。
(4)现用四氯化硅和氮气在氢气气氛保护下,加强热发生反应,可得到较高纯度的氮化硅,反应的化学方程式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在金刚石的晶体中,含有由共价键形成的碳原子环,其中最小的环上所需碳原子数及每个碳原子上任意两个C—C键间的夹角是( )
A.6个 120°B.5个 108°
C.4个 109.5°D.6个 109.5°
查看答案和解析>>
科目:高中化学 来源: 题型:
最近,美国普度大学的研究人员开发出一种利用铝镓合金加水制造氢气的新工艺。这项技术具有广泛的能源潜在用途,包括为汽车提供原料、为潜水艇提供燃料等。该技术通过向铝镓合金注水,铝生成氧化铝,同时生成氢气。合金中镓(Ga,ⅢA族元素)是关键成分,可阻止铝形成致密的氧化膜。下列关于铝、镓的说法正确的是( )
A.铝的金属性比镓强
B.铝的熔点比镓低
C.Ga(OH)3与Al(OH)3性质相似,一定能与NaOH溶液反应
D.铝、镓合金与水反应后的物质可以回收利用冶炼铝
查看答案和解析>>
科目:高中化学 来源: 题型:
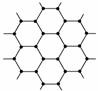
石墨晶体是层状结构(如右图),在每一层内,每一个碳原子都跟其他3个碳原子相结合,据图分析,石墨晶体中碳原子数和共价键数之比为( )
A.2∶3 B.2∶1
C.1∶3 D.3∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com